题目内容
元素金(Au)处于周期表中的第六周期,与Cu同族,其价电子排布与Cu相似,Au原子的价电子排布式为 ;一种铜金合金晶体具有立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,则该合金中Cu原子与Au原子数量之比为 ;该晶体中,原子之间的强相互作用是 ;上述晶体具有储氢功能,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中.若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与CaF2(如图)的结构相似,该晶体储氢后的化学式应为 .
考点:原子核外电子排布,晶胞的计算
专题:化学键与晶体结构
分析:铜是29号元素,在元素周期表位置:第四周期、ⅠB族,价电子排布式为3d104s1,Au原子的价电子排布式为5d106s1;
根据均摊法计算晶胞中Cu、Au原子数目,确定合金中二者原子数目之比;
铜金合金晶体属于金属晶体,据此判断化学键类型;
CaF2的结构如图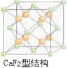 ,利用均摊法计算.
,利用均摊法计算.
根据均摊法计算晶胞中Cu、Au原子数目,确定合金中二者原子数目之比;
铜金合金晶体属于金属晶体,据此判断化学键类型;
CaF2的结构如图
 ,利用均摊法计算.
,利用均摊法计算.解答:
解:铜是29号元素,在元素周期表位置:第四周期、ⅠB族,价电子排布式为3d104s1,元素金(Au)处于周期表中的第六周期,与Cu同族,其价电子排布与Cu相似,Au原子的价电子排布式为5d106s1;
铜金合金晶体具有面心立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,则晶胞中Cu原子数目=6×
=3,晶胞中Au原子数目=8×
=1,故晶胞中Cu原子与Au原子数量之比为3:1;铜金合金晶体属于金属晶体,含有化学键类型为金属键;
CaF2的结构如图 ,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中,则H原子应位于晶胞内部,则应含有8个H,则化学式为Cu3AuH8,
,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中,则H原子应位于晶胞内部,则应含有8个H,则化学式为Cu3AuH8,
故答案为:5d106s1;3:1;金属键;Cu3AuH8.
铜金合金晶体具有面心立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,则晶胞中Cu原子数目=6×
| 1 |
| 2 |
| 1 |
| 8 |
CaF2的结构如图
 ,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中,则H原子应位于晶胞内部,则应含有8个H,则化学式为Cu3AuH8,
,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中,则H原子应位于晶胞内部,则应含有8个H,则化学式为Cu3AuH8,故答案为:5d106s1;3:1;金属键;Cu3AuH8.
点评:本题考查元素的核外电子排布式、化学键类型、均摊法计算原子个数比及化学式等知识,题目难度中等,注意均摊法的应用和知识的迁移能力的培养.

练习册系列答案
 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案
相关题目
物质的熔沸点能用键能大小解释的是( )
| A、H2O>H2S |
| B、O2>N2 |
| C、Na>K |
| D、SiO2>CO2 |
 如图中横坐标为加入反应物的物质的量,纵坐标为产生沉淀的物质的量.下列选项编号对应的曲线编号错误的是( )
如图中横坐标为加入反应物的物质的量,纵坐标为产生沉淀的物质的量.下列选项编号对应的曲线编号错误的是( )| A、向NaAlO2溶液中逐渐滴入HCl至过量 |
| B、向澄清石灰水中通入SO2至过量 |
| C、向含有盐酸的AlCl3溶液中滴入NaOH溶液至过量 |
| D、向含有等物质的量的Ca(OH)2、KOH的混合溶液中通入CO2至过量 |
我国的“神州七号”载人飞船已发射成功,“嫦娥”探月工程已正式启动.据科学家预测,月球的土壤中吸附着数百万吨的
He,每百吨
He核聚变所释放出的能量相当于目前人类一年消耗的能量.在地球上,氦元素主要以
He的形式存在.下列说法正确的是( )
3 2 |
3 2 |
4 2 |
A、
| ||||
B、
| ||||
C、
| ||||
D、
|
 (1)太阳能热水器中常使用一种以镍或镍合金空心球为吸收剂的太阳能吸热涂层,写出基态镍原子的核外电子排布式
(1)太阳能热水器中常使用一种以镍或镍合金空心球为吸收剂的太阳能吸热涂层,写出基态镍原子的核外电子排布式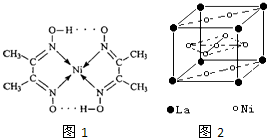 目前,全世界镍的消费量仅次于铜、铝、铅、锌,居有色金属第五位.镍行业发展蕴藏着巨大潜力.
目前,全世界镍的消费量仅次于铜、铝、铅、锌,居有色金属第五位.镍行业发展蕴藏着巨大潜力. 、④HCHO等,其中碳原子采取sp2杂化的分子有
、④HCHO等,其中碳原子采取sp2杂化的分子有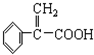 )及高聚物F.
)及高聚物F.
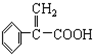 具有相同官能团且属于芳香族化合物的同分异构体有
具有相同官能团且属于芳香族化合物的同分异构体有 的任意一个同分异构体的结构简式
的任意一个同分异构体的结构简式