题目内容
【题目】某化学兴趣小组欲制备并探究![]() 的某些性质。
的某些性质。
(1)下列实验方案适用于在实验室制取所需![]() 的是________。
的是________。
A.![]() 溶液与
溶液与![]()
![]() 固体与浓硫酸
固体与浓硫酸
C.固体硫在纯氧中燃烧 ![]() 高温煅烧硫铁矿
高温煅烧硫铁矿
(2)探究二氧化硫的漂白性
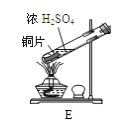
甲同学用如图所示装置![]() 气密性良好
气密性良好![]() 进行实验,观察到如下现象:Ⅰ中红色褪去,Ⅱ中无变化。
进行实验,观察到如下现象:Ⅰ中红色褪去,Ⅱ中无变化。
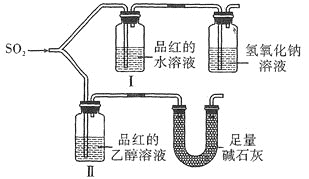
![]() 甲同学设计对照实验,但用足量碱石灰代替了氢氧化钠溶液,其原因是________________,根据实验现象得出的实验结论是_____________。
甲同学设计对照实验,但用足量碱石灰代替了氢氧化钠溶液,其原因是________________,根据实验现象得出的实验结论是_____________。
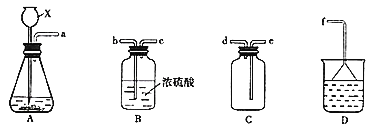
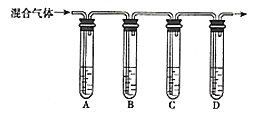
(3)乙同学设计用如图所示装置验证二氧化硫的化学性质。

![]() 能说明二氧化硫具有氧化性的实验序号为________
能说明二氧化硫具有氧化性的实验序号为________![]() 填字母
填字母![]() 。
。
![]() 为了验证c中
为了验证c中![]() 与
与![]() 发生了氧化还原反应,在上图装置中通入过量的
发生了氧化还原反应,在上图装置中通入过量的![]() 后,取c中的溶液,分成三份,并设计了如下实验:
后,取c中的溶液,分成三份,并设计了如下实验:
方案Ⅰ:往第一份试液中加入酸性![]() 溶液,紫色褪去;
溶液,紫色褪去;
方案Ⅱ:往第二份试液中加入KSCN溶液不变红,再加入新制的氯水,溶液变红;
方案Ⅲ:往第三份试液中加入用盐酸酸化的![]() 溶液,产生白色沉淀。
溶液,产生白色沉淀。
指出上述不合理的方案并说明原因:______________________________________________。
![]() 试管e中发生反应的离子方程式为______________________________________________。
试管e中发生反应的离子方程式为______________________________________________。
【答案】![]() 碱石灰吸收尾气二氧化硫的同时,还可以防止空气中的水蒸气进入Ⅱ,对实验产生干扰 二氧化硫在有水存在的条件下能使品红溶液褪色 b 方案Ⅰ,
碱石灰吸收尾气二氧化硫的同时,还可以防止空气中的水蒸气进入Ⅱ,对实验产生干扰 二氧化硫在有水存在的条件下能使品红溶液褪色 b 方案Ⅰ,![]() 易溶于水,A溶液中含有的
易溶于水,A溶液中含有的![]() 也能使酸性
也能使酸性![]() 溶液褪色
溶液褪色 ![]() 。
。
【解析】
(1)根据实验室制取二氧化硫的原理分析判断制备方法;
(2)结合碱石灰和氢氧化钠溶液的性质和作用分析实验目的;
(3)装置A中浓硫酸和亚硫酸钠反应制取二氧化硫,通入a中时品红褪色,可说明二氧化硫具有漂白性;通入b中与硫化钠反应生成硫沉淀,二氧化硫中硫的化合价降低,说明二氧化硫具有氧化性;通入c中与氯化铁溶液反应生成亚铁离子,溶液由棕黄色变为浅绿色,说吗二氧化硫氧化性比铁离子弱;通入d中新制氯水黄绿色消失,说明氯水中的氯气和二氧化硫反应,且氯气的氧化性强于二氧化硫;通入到e中使高锰酸钾溶液褪色,说明二氧化硫与高锰酸钾发生反应,二氧化硫具有还原性;装置f为尾气吸收装置,用氢氧化钠溶液吸收多余的二氧化硫。
①根据氧化还原反应规律,二氧化硫化合价降低,得电子被还原,在反应中做氧化剂;
②二氧化硫能与高锰酸钾发生氧化还原反应使高锰酸钾溶液褪色,Fe2+也使高锰酸钾溶液褪色;
③二氧化硫能与高锰酸钾溶液发生氧化还原反应使高锰酸钾溶液褪色生成硫酸锰和硫酸;
(1)A.有强还原性的![]() 与强氧化性的
与强氧化性的![]() 发生氧化还原反应生成
发生氧化还原反应生成![]() ,故A错误;
,故A错误;
B.![]() 固体与浓硫酸可以制备二氧化硫,故B正确;
固体与浓硫酸可以制备二氧化硫,故B正确;
C.固体硫在纯氧中燃烧,生成![]() 中含有
中含有![]() ,故C错误;
,故C错误;
D.高温煅烧硫铁矿是工业上制![]() ,故D错误;
,故D错误;
故答案选B;
(2)品红的水溶液与品红的乙醇溶液相比较不同的是溶剂,甲实验的目的是探究二氧化硫使品红溶液褪色是否需要水参与。碱石灰的作用是吸收空气中的水蒸气,防止空气中的水蒸气进入Ⅱ,对实验产生干扰,同时吸收尾气二氧化硫。甲得出的结论是二氧化硫在有水存在的条件下能使品红溶液褪色。
(3)![]() 中发生反应
中发生反应![]() ,
,![]() 作氧化剂,体现氧化性。
作氧化剂,体现氧化性。
![]() 与
与![]() 发生了氧化还原反应生成了
发生了氧化还原反应生成了![]() 和
和![]() ,方案Ⅰ中认为酸性
,方案Ⅰ中认为酸性![]() 溶液褪色是与
溶液褪色是与![]() 反应的,其实
反应的,其实![]() 易溶于水,c溶液中含有的
易溶于水,c溶液中含有的![]() 也能使性
也能使性![]() 溶液褪色,所以方案Ⅰ不合理;方案Ⅱ证明有
溶液褪色,所以方案Ⅰ不合理;方案Ⅱ证明有![]() ,说明
,说明![]() 与
与![]() 发生了氧化还原反应生成了
发生了氧化还原反应生成了![]() ;方案Ⅲ证明有
;方案Ⅲ证明有![]() ,说明
,说明![]() 与
与![]() 发生了氧化还原反应生成了
发生了氧化还原反应生成了![]() ;
;
![]() 能使酸性
能使酸性![]() 溶液褪色,发生离子反应为
溶液褪色,发生离子反应为![]() 。
。

【题目】现有部分短周期元素的性质或原子结构如表所示:
元素编号 | 元素性质或原子结构 |
T | M层上电子数是K层上电子数的3倍 |
X | 最外层电子数是次外电子数的2倍 |
Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
Z | 元素最高正价是+7价 |
(1)元素X位于元素周期表的第________周期______族;
(2)元素Y的原子结构示意图为________。
(3)元素Z与元素T相比,非金属性较强的是________(用元素符号表示),下列表述中能证明这一事实的是________(填序号)。
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应