题目内容
用31.6g KMnO4恰好氧化密度为1.19g/cm3,溶质质量分数为36.5% 的盐酸.反应方程式如下:
2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O
(1)标出以上反应电子转移的方向和数目.
(2)有多少摩尔HCl被氧化?
(3)产生的Cl2在标准状况下的体积为多少?
(4)求消耗该盐酸溶液的体积?
2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O
(1)标出以上反应电子转移的方向和数目.
(2)有多少摩尔HCl被氧化?
1mol
1mol
(3)产生的Cl2在标准状况下的体积为多少?
11.2L
11.2L
(4)求消耗该盐酸溶液的体积?
0.134L
0.134L
.分析:(1)反应中高锰酸钾为氧化剂,HCl为还原剂,根据Mn元素的化合价+7→+2,和Cl元素的化合价-1→0,标出电子的转移方向和数目;
(2)被氧化的HCl生成氯气,根据方程式计算生成氯气的物质的量,再根据氯原子守恒计算被氧化的HCl的物质的量;
(3)根据V=nVm计算生成氯气的体积;
(4)根据方程式计算消耗的HCl的物质的量,根据c=
计算盐酸的物质的量浓度,再根据V=
计算消耗盐酸的体积.
(2)被氧化的HCl生成氯气,根据方程式计算生成氯气的物质的量,再根据氯原子守恒计算被氧化的HCl的物质的量;
(3)根据V=nVm计算生成氯气的体积;
(4)根据方程式计算消耗的HCl的物质的量,根据c=
| 1000ρw |
| M |
| n |
| c |
解答:解:(1)反应中高锰酸钾为氧化剂,HCl为还原剂,Mn元素的化合价+7→+2,和Cl元素的化合价-1→0,反应中氧化剂和还原剂得失电子数目相等,反应电子转移的方向和数目为: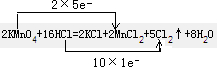 ,
,
答:反应电子转移的方向和数目为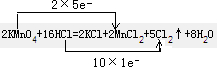 ;
;
(2)31.6g KMnO4的物质的量为
=0.2mol,则:
2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O
2 16 5
0.2mol n(HCl) n(Cl2)
所以,n(Cl2)=
=0.5mol,被氧化的HCl生成氯气,故被氧化的HCl的物质的量为0.5mol×2=1mol,故答案为:1mol;
(3)V(Cl2)=0.5mol×22.4L/mol=11.2L,故答案为:11.2L;
(4)消耗的n(HCl)=
=1.6mol,
该盐酸的物质的量浓度为
mol/L=11.9mol/L,
故消耗盐酸的体积为
=0.134L,
故答案为:0.134L.
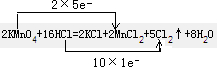 ,
,答:反应电子转移的方向和数目为
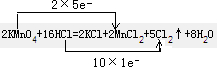 ;
;(2)31.6g KMnO4的物质的量为
| 31.6g |
| 158g/mol |
2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O
2 16 5
0.2mol n(HCl) n(Cl2)
所以,n(Cl2)=
| 0.2mol×5 |
| 2 |
(3)V(Cl2)=0.5mol×22.4L/mol=11.2L,故答案为:11.2L;
(4)消耗的n(HCl)=
| 0.2mol×16 |
| 2 |
该盐酸的物质的量浓度为
| 1000×1.19×36.5% |
| 36.5 |
故消耗盐酸的体积为
| 1.6mol |
| 11.9mol/L |
故答案为:0.134L.
点评:本题考查化学方程式的有关计算,难度不大,本题注意物质的量浓度与质量分数的关系公式的利用以及电子转移的方向和数目的表示方法.

练习册系列答案
相关题目