题目内容
17.已知反应 Na2S2O3+H2SO4═Na2SO4+S↓+SO2+H2O,某同学按表进行实验,最先出现浑浊的一组应该是( )
| 加3%Na2S2O3/mL | 加1:5的H2SO4/滴 | 温度/℃ | |
| A | 5 | 25 | 25 |
| B | 5 | 15 | 35 |
| C | 5 | 25 | 45 |
| D | 5 | 15 | 45 |
| A. | A | B. | B | C. | C | D. | D |
分析 各组实验中最先出现浑浊说明反应速率越快,温度越高、浓度越大反应速率越大,且温度对化学反应速率影响大于浓度对化学反应速率影响,据此判断反应速率快慢.
解答 解:各组实验中最先出现浑浊说明反应速率越快,温度越高、浓度越大反应速率越大,且温度对化学反应速率影响大于浓度对化学反应速率影响,
通过表中数据知,C、D温度高于A、B,所以C、D反应速率大于A、B,C中加入硫酸较多,则浓度大于D,所以C反应速率大于D;
则最先出现沉淀的是C,
故选C.
点评 本题考查化学反应速率影响因素,为高频考点,正确判断浓度、温度对化学反应速率影响是解本题关键,注意:温度影响大于浓度影响,题目难度不大.

练习册系列答案
相关题目
7.通常情况下,不能用铁制容器盛放的是( )
| A. | 浓硫酸 | B. | 盐酸 | C. | 汽油 | D. | 酒精 |
8.己知有如下反应:①2BrO3-+Cl2═Br2+2ClO3-
②ClO-+5Cl-+6H+═3Cl2+3H2O
③2FeCl2+Cl2═2FeCl3
根据上述反应,判断下列结论中错误的是( )
②ClO-+5Cl-+6H+═3Cl2+3H2O
③2FeCl2+Cl2═2FeCl3
根据上述反应,判断下列结论中错误的是( )
| A. | Cl2是在反应②中既是氧化产物又是还原产物 | |
| B. | 氧化性强弱的顺序为:BrO3->ClO3->Cl2>Fe3+ | |
| C. | 溶液中可发生:ClO3-+6Fe2++6H+═Cl-+6Fe3++3H2O | |
| D. | Cl2在①、③反应中均作氧化剂 |
5.表是A、B、C、D五中有机物质的相关信息:
(1)A与氢气发生加成反应后生成分子F,F在分子组成和结构上相似的有机物有一大类(俗称“同系物”),它们均符合通式CnH2n+2.当n=4时,这类有机物开始出现同分异构体.
(2)A与溴的四氯化碳溶液反应的生成物的结构简式CH2BrCH2Br;该生成物在一定条件下可用于制取最简单的二元醇方程式为:CH2BrCH2Br+2NaOH$→_{△}^{水}$CH2OHCH2OH+2NaBr.
(3)B具有的性质是②③(填序号):①无色无味液体、②有毒、③不溶于水、④密度比水大、⑤与酸性KMnO4溶液和溴水反应褪色、⑥任何条件下不与氢气反应;写出在催化剂作用下,B与溴反应的化学方程式: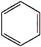 +Br2$\stackrel{FeBr_{3}}{→}$
+Br2$\stackrel{FeBr_{3}}{→}$ +HBr.
+HBr.
(4)C与E反应能生成酯,该反应类型为取代反应;其化学反应方程式为:CH2=CHCOOH+CH3CH2OH$?_{△}^{H_{2}SO_{4}}$CH2=CHCOOOCH2CH3+H2O.
(5)D在一定条件下能发生银镜反应,其化学反应方程式:CH3CHO+2[Ag(NH3)2]OH$\stackrel{△}{→}$CH3COONH4+2Ag↓+3NH3+H2O.
| A | B | C | D | E |
| ①能使溴的四氯化碳溶液褪色; ②比例模型为:  ③能与水在一定条件下反应生成C | ①由C、H两种元素组成; ②球棍模型为  | ①由C、H、O三种元素组成; ②能与Na反应,但不能与NaOH溶液反应; ③能与E反应生成相对分子质量为100的酯. | ①相对分子质量比C少2; ②能由C氧化而成; | ①由C、H、O三种元素组成; ②球棍模型为:  |
(2)A与溴的四氯化碳溶液反应的生成物的结构简式CH2BrCH2Br;该生成物在一定条件下可用于制取最简单的二元醇方程式为:CH2BrCH2Br+2NaOH$→_{△}^{水}$CH2OHCH2OH+2NaBr.
(3)B具有的性质是②③(填序号):①无色无味液体、②有毒、③不溶于水、④密度比水大、⑤与酸性KMnO4溶液和溴水反应褪色、⑥任何条件下不与氢气反应;写出在催化剂作用下,B与溴反应的化学方程式:
 +Br2$\stackrel{FeBr_{3}}{→}$
+Br2$\stackrel{FeBr_{3}}{→}$ +HBr.
+HBr.(4)C与E反应能生成酯,该反应类型为取代反应;其化学反应方程式为:CH2=CHCOOH+CH3CH2OH$?_{△}^{H_{2}SO_{4}}$CH2=CHCOOOCH2CH3+H2O.
(5)D在一定条件下能发生银镜反应,其化学反应方程式:CH3CHO+2[Ag(NH3)2]OH$\stackrel{△}{→}$CH3COONH4+2Ag↓+3NH3+H2O.
12.下列变化会释放出能量的是( )
| A. | 碘升华 | B. | 酒精用于降温 | ||
| C. | 铝热反应 | D. | Ba(OH)2•8H2O和NH4Cl反应 |
2.下列指定微粒的数目相等的是( )
| A. | 等物质的量的水与重水含有的中子数 | |
| B. | 等质量的乙烯和丙烯中含有的共用电子对数 | |
| C. | 同温、同压、同体积的CO和NO含有的质子数 | |
| D. | 等物质的量的铁和铜分别与氯气完全反应,转移的电子数 |
9. 我国科学家发明的一种可控锂水电池,可作为鱼雷和潜艇的储备电源.其工作原理如图所示.下列有关说法不正确的是( )
我国科学家发明的一种可控锂水电池,可作为鱼雷和潜艇的储备电源.其工作原理如图所示.下列有关说法不正确的是( )
 我国科学家发明的一种可控锂水电池,可作为鱼雷和潜艇的储备电源.其工作原理如图所示.下列有关说法不正确的是( )
我国科学家发明的一种可控锂水电池,可作为鱼雷和潜艇的储备电源.其工作原理如图所示.下列有关说法不正确的是( )| A. | 电池工作时,电子的流向:锂电极→导线→碳电极 | |
| B. | 水既是氧化剂又是溶剂,有机电解质可用水溶液代替 | |
| C. | 电池总反应为2Li+2H2O=2LiOH+H2 | |
| D. | 该装置不仅可提供电能,还可得到清洁燃料氢气 |
6.下列说法中正确的是( )
| A. | 元素从化合态变为游离态,该元素一定被还原 | |
| B. | 铝合金比纯铝的熔点更高 | |
| C. | 保存FeCl3溶液时,通常在溶液中加少量的单质铁 | |
| D. | 漂白粉应隔绝空气密封保存 |
7.下列各组数据关系中,前者比后者大的是( )
| A. | 纯水100℃和25℃的pH值 | |
| B. | 氢硫酸溶液中的H+和HS-的浓度 | |
| C. | 100mL0.1mol/L的CH3COOH溶液与10mL1.0mol/L的CH3COOH溶液中H+数目 | |
| D. | 25℃,pH=11的KOH溶液与pH=3的CH3COOH溶液中由水电离出的OH-离子浓度 |