题目内容
硫酸盐主要来自地层矿物质,多以硫酸钙、硫酸镁的形态存在。
(1)已知:①Na2SO4(s)=Na2S(s)+2O2(g) ; ΔH1= +1011.0 kJ · mol-1
②C(s)+O2(g)=CO2(g) ; ΔH2=-393.5 kJ · mol-1
③2C(s)+O2(g)=2CO(g) ; ΔH3=-221.0 kJ · mol-1
则反应④Na2SO4(s)+4C(s)=Na2S(s)+4CO(g);ΔH4= kJ · mol-1,该反应能自发进行的原因是 ;工业上制备Na2S不用反应①,而用反应④的理由是 。
(2)已知不同温度下2SO2+O2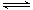 2SO3的平衡常数见下表。
2SO3的平衡常数见下表。
|
温度(℃) |
527 |
758 |
927 |
|
平衡常数 |
784 |
1.0 |
0.04 |
1233℃时,CaSO4热解所得气体的主要成分是SO2和O2,而不是SO3的原因是 。
(3)高温时,用CO还原MgSO4可制备高纯MgO。
①750℃时,测得气体中含等物质的量SO2和SO3,此时反应的化学方程式是 。
②将上述反应获得的SO2通入含PtCl42-的酸性溶液,可还原出Pt,则反应的离子方程式是 。
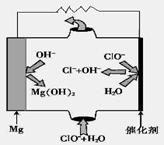
③由MgO可制成“镁—次氯酸盐”燃料电池,其装置示意图如图,则正极的电极反应式为 。

(1)569 ΔS<0 CO能够保护Na2S不被氧化;(2)1233℃时平衡常数远小于1,气体主要以SO2
和O2的形式存在;(3)CO+2MgSO4 2MgO+CO2+SO2+SO3
2MgO+CO2+SO2+SO3
PtCl42-+SO2+H2O===SO42-+4H++4Cl-+Pt↓ Mg+ClO-+H2O=Cl-+Mg(OH)2。
【解析】
试题分析:(1)将方程式①+2③得Na2SO4(s)+4C(s)═Na2S(s)+4CO(g)△H3=+1011.0kJ•mol-1+2(-221.0kJ•mol-1)=+569kJ/mol;根据反映方程式可知,反应物都为固体,产物有气体生成,故ΔS<0,ΔG=△H-TΔS,故该反应能自发进行;CO能够保护Na2S不被氧化;(2)1233℃时平衡常数远小于1,气体主要以SO2和O2的形式存在;(3)①用CO还原MgSO4可得到MgO、CO2、SO2和SO3,方程式为CO+2MgSO4 2MgO+CO2+SO2+SO3;② PtCl42-+SO2+H2O=SO42-+4H++4Cl-+Pt↓;
③由图可知镁-次氯酸盐”燃料电池中Mg与ClO-、H2O反应生成Cl-与Mg(OH)2,该电池反应的总反应方程式为Mg+ClO-+H2O=Cl-+Mg(OH)2。
2MgO+CO2+SO2+SO3;② PtCl42-+SO2+H2O=SO42-+4H++4Cl-+Pt↓;
③由图可知镁-次氯酸盐”燃料电池中Mg与ClO-、H2O反应生成Cl-与Mg(OH)2,该电池反应的总反应方程式为Mg+ClO-+H2O=Cl-+Mg(OH)2。
考点:热化学方程式;反应热和焓变;化学平衡常数的含义 。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A、NOX主要来自于汽车尾气的排放,是引起温室效应的主要气体之一 | B、N2中Π键与O键之比为1:2 | C、反应③中每生成22.4LN2,转移电子数1.5NA | D、NH3的沸点比PH3的沸点高 |
| 主 食 | 米 饭 |
| 副 食 | 红烧鱼 |
| 饮 品 | 豆 浆 |
| 你的补充 | ? |
(14分)硫酸盐主要来自地层矿物质,多以硫酸钙、硫酸镁的形态存在。
(1)已知:①Na2SO4(s)=Na2S(s)+2O2(g) ΔH1=+1011.0 kJ·mol-1
②C(s)+O2(g)=CO2(g) ΔH2=-393.5 kJ·mol-1
③2C(s)+O2(g)=2CO(g) ΔH3=-221.0 kJ·mol-1
则反应④Na2SO4(s)+4C(s)=Na2S(s)+4CO(g) ΔH4=________kJ·mol-1;工业上制备Na2S时往往还要加入过量的炭,同时还要通入空气,目的有两个,其一是使硫酸钠得到充分还原(或提高Na2S产量),其二是_____________________________________________。
(2)智能材料是当今材料研究的重要方向之一,纳米Fe3O4由于具有高的比表面、高的比饱和磁化强度和顺磁为零的超顺磁性而被广泛地用作磁流体的磁性粒子。水热法制备Fe3O4纳米颗粒的反应是:
3Fe2+ + 2S2O32- + O2 + xOH-=Fe3O4+S4O62-+2H2O
请回答下列问题:
①水热法所制得的水基磁流体超过30天都未出现分层和混浊现象,因为该分散系是________。
②上述反应方程式x=___________________。
③该反应中1molFe2+被氧化时,被Fe2+还原的O2的物质的量为_____。
(3)高温时,用CO还原MgSO4可制备高纯MgO。
①750℃时,测得气体中含等物质的量SO2和SO3,此时反应的化学方程式是____________。
②由MgO可制成“镁—次氯酸盐”燃料电池,其装置示意图如上图,该电池反应的化学方程式为_____________________________________________________。
