题目内容
6.下列表示正确的是( )| A. | 羟基的电子式 | B. | 二氧化硅的结构式 O=Si=O | ||
| C. | NH3的球棍模型 | D. | X=11,图表示钠原子的结构示意图 |
分析 A.羟基由一个氧原子和一个氢原子构成,氧原子最外层6个电子,氢原子最外层一个电子,二者形成一个共用电子对;
B.二氧化硅为原子晶体,晶体中不存在硅氧双键;
C.氨气为三角锥的空间构型,选项中为比例模型;
D.钠原子核内有11个质子,核外有3个电子层,最外层上有1个电子.
解答 解;A.羟基由一个氧原子和一个氢原子构成,氧原子最外层6个电子,氢原子最外层一个电子,二者形成一个共用电子对,所以羟基的电子式是 ,故A正确;
,故A正确;
B.由于二氧化硅为原子晶体,1个硅原子形成4个硅氧键,1个氧原子形成2个硅氧键,所以二氧化硅中不存在硅氧双键,故B错误;
C.氨气为三角锥的空间构型,故氨气的球棍模型为 ,故C错误;
,故C错误;
D.钠原子核内有11个质子,核外有3个电子层,第一层上有2个电子、第二层上有8个电子,最外层上有1个电子,其原子结构示意图为: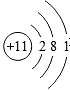 ,故D错误;
,故D错误;
故选A.
点评 本题考查常用化学用语,涉及电子式、结构示意图、结构式、球棍模型等,题目难度不大,注意羟基为中性原子团.

练习册系列答案
相关题目
7.下列有机化学反应方程式书写及反应类型均正确的是( )
| A. | CH2=CH2+HCl $\stackrel{催化剂}{→}$CH3CH2Cl 加聚反应 | |
| B. | CH3COOCH2CH3+NaOH→CH3COONa+CH3CH2OH 取代反应 | |
| C. |  +Br2$\stackrel{FeBr_{3}}{→}$ +Br2$\stackrel{FeBr_{3}}{→}$ +HBr 加成反应 +HBr 加成反应 | |
| D. |  +HNO3$→_{50~60℃}^{浓H_{2}SO_{4}}$ +HNO3$→_{50~60℃}^{浓H_{2}SO_{4}}$ +H2O 取代反应 +H2O 取代反应 |
8.如图所示实验方案无法达到预期实验目的是( )
| A. |  用图制备Fe(OH)2 | B. |  用图制备少量Cl2 | ||
| C. |  用图制备并收集O2 | D. |  用图比较S、C、Si的非金属性强弱 |
14. 非金属及其化合物在工农业生产、生活中有着重要应用,减少非金属的氧化物在大气中的排放是环境保护的重要内容之一.
非金属及其化合物在工农业生产、生活中有着重要应用,减少非金属的氧化物在大气中的排放是环境保护的重要内容之一.
(1)已知:N2(g)+O2(g)=2NO(g)△H=+180.5kJ•mol-1
C(s)+O2(g)=CO2(g)△H=-393.5kJ•mol-1
2C(s)+O2(g)=2CO(g)△H=-221kJ•mol-1
若某反应的平衡常数表达式为:K=$\frac{c({N}_{2})•{c}^{2}(C{O}_{2})}{c(NO)•{c}^{2}(CO)}$,请写出此反应的热化学方程式2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-746.5 kJ•mol-1.
(2)N2O5在一定条件下可发生分解:2N2O5(g)?4NO2(g)+O2(g).△H>0.某温度下测得恒容密闭容器中N2O5浓度随时间的变化如表:
反应开始时体系压强为P0,第3.00min时达到平衡体系压强为p1,则p1:p0=1.975;1.00min~3.00min内,O2的平均反应速率为0.09mol•L-1•min-1.从表中可知化学反应速率变化规律是随反应时间进行,反应物浓度降低,化学反应速率减少.
①该温度下反应的平衡常数Kp=$\frac{(1.3{P}_{0})^{4}×(0.325{P}_{0})}{(0.35{p}_{0})^{2}}$(用平衡分压代替平衡浓度计算,分压=总压×物质的量的分数,请列出用P0表示平衡常数表达式,不用计算).
②一定温度下,在恒容密闭容器中充入一定量N2O5进行该反应,能判断反应已达到化学平衡状态的是a.
a.容器中压强不再变化 b.NO2和O2的体积比保持不变
c.2v正(NO2)=v逆(N2O5) d.混合气体的密度保持不变
(3)从N2O5可通过电解或臭氧氧化N2O4的方法制备.电解装置如图所示(隔膜用于阻止水分子通过),其阳极反应式为N2O4+2NO3--2e-=2N2O5.
 非金属及其化合物在工农业生产、生活中有着重要应用,减少非金属的氧化物在大气中的排放是环境保护的重要内容之一.
非金属及其化合物在工农业生产、生活中有着重要应用,减少非金属的氧化物在大气中的排放是环境保护的重要内容之一.(1)已知:N2(g)+O2(g)=2NO(g)△H=+180.5kJ•mol-1
C(s)+O2(g)=CO2(g)△H=-393.5kJ•mol-1
2C(s)+O2(g)=2CO(g)△H=-221kJ•mol-1
若某反应的平衡常数表达式为:K=$\frac{c({N}_{2})•{c}^{2}(C{O}_{2})}{c(NO)•{c}^{2}(CO)}$,请写出此反应的热化学方程式2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-746.5 kJ•mol-1.
(2)N2O5在一定条件下可发生分解:2N2O5(g)?4NO2(g)+O2(g).△H>0.某温度下测得恒容密闭容器中N2O5浓度随时间的变化如表:
| t/min | 0.00 | 1.00 | 2.00 | 3.00 | 4.00 | 5.00 |
| c(N2O5)/(mo•L-1) | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
①该温度下反应的平衡常数Kp=$\frac{(1.3{P}_{0})^{4}×(0.325{P}_{0})}{(0.35{p}_{0})^{2}}$(用平衡分压代替平衡浓度计算,分压=总压×物质的量的分数,请列出用P0表示平衡常数表达式,不用计算).
②一定温度下,在恒容密闭容器中充入一定量N2O5进行该反应,能判断反应已达到化学平衡状态的是a.
a.容器中压强不再变化 b.NO2和O2的体积比保持不变
c.2v正(NO2)=v逆(N2O5) d.混合气体的密度保持不变
(3)从N2O5可通过电解或臭氧氧化N2O4的方法制备.电解装置如图所示(隔膜用于阻止水分子通过),其阳极反应式为N2O4+2NO3--2e-=2N2O5.
1.在绿色化学工艺中,理想状态是反应物中的原子全部转化为欲制得的产物,即原子利用率为100%.在用 CH3C≡CH 合成 CH2═C(CH3)COOCH3 的过程中,欲使原子利用率达到最高,还需要的其他反应物有( )
| A. | CO2 和 H2O | B. | CO 和 CH3OH | C. | CH3OH 和 H2 | D. | H2 和 CO2 |
11.下列物质中,含有极性键的离子化合物( )
| A. | HCl | B. | KOH | C. | CaCl2 | D. | O2 |
18.某同学欲用图装置测定镀锌铁皮的镀层厚度.两片正方形电极的边长均为a cm.下列说法正确的是( )


| A. | 电流表指针不会发生偏转 | B. | 除去锌镀层的铁片为负极 | ||
| C. | 负极的电极反应式:Fe-2e→Fe2+ | D. | 锌镀层反应完毕后电流计指针归零 |
16.恒温、恒压下,1molA和nmolB在一个容积可变的密闭容器中发生如下反应:A(g)+2B(g)?2C(g),一段时间后达到平衡,生成amolC,则下列说法中正确的是( )
| A. | 当n=2时,物质A、B的转化率之比为1:2 | |
| B. | 起始时刻和达到平衡后容器中的压强比为(1+n):(l+n-$\frac{a}{2}$) | |
| C. | 当v (A)正=2v (C)逆时,可断定反应达到平衡 | |
| D. | 容器中混合气体的密度不再随时间改变而改变,反应到达平衡状态 |