题目内容
12.草木灰中含有可溶性钾盐(主要成分是K2SO4、K2CO3、KCl).某学生按下列操作提取草木灰中的钾盐:①取草木灰加水溶解;②过滤.取滤液;③蒸发滤液;④冷却结晶.为检验草木灰中的阴离子,取少量晶体溶于水,并把溶液分成三等份:(1)取一份溶液,加入适量HCl,观察到有气泡产生,证明含有碳酸根.
(2)取另一份溶液,为检验SO42-,应往溶液中先加入过量的盐酸,再加入BaCl2溶液.
(3)取剩余的一份溶液,加适量的硝酸银,观察到有沉淀产生,该生由此证明溶液中一定含Cl-.你认为所得的结论是否严密?否.理由是碳酸根离子、硫酸根离子也会和银离子结合生成白色沉淀.
分析 (1)加入盐酸会生成二氧化碳气体;
(2)检验硫酸根离子的存在,应先排除碳酸根离子的干扰;
(3)硝酸银和氯离子、碳酸根离子、硫酸根离子都会生成白色沉淀.
解答 解:草木灰中含有可溶性钾盐(主要成分是K2SO4、K2CO3、KCl);
(1)取一份溶液,加入适量HCl,发生反应CO32-+2H+═CO2↑+H2O,溶液中有气泡生成,证明含有碳酸根离子,
故答案为:有气泡产生;
(2)取另一份溶液,为检验SO42-,应先加过量盐酸排除干扰离子,再加氯化钡溶液生成白色沉淀,Ba2++SO42-═BaSO4↓,证明含有硫酸根离子,
故答案为:盐酸;
(3)取剩余的一份溶液,加适量的硝酸银,观察到有沉淀产生,可能是氯离子、碳酸根离子、硫酸根离子和银离子生成的白色沉淀,不能证明溶液中一定含有氯离子,
故答案为:否;碳酸根离子、硫酸根离子也会和银离子结合生成白色沉淀.
点评 本题考查离子检验及物质的检验和鉴别,为高频考点,把握常见离子的检验方法及排除试剂的干扰为解答的关键,侧重分析与实验能力的考查,题目难度不大.

练习册系列答案
相关题目
2.可逆反应:3A(g)+B(g)?2C(g)+2D(g) 在不同条件下的反应速率分别为:
(1)v(A)=0.6mol•L-1•min-1 (2)v(B)=0.005mol•L-1•S-1
(3)v(C)=0.4mol•L-1•min-1 (4)v(D)=0.80mol•L-1•min-1
此反应在不同条件下进行最快的是( )
(1)v(A)=0.6mol•L-1•min-1 (2)v(B)=0.005mol•L-1•S-1
(3)v(C)=0.4mol•L-1•min-1 (4)v(D)=0.80mol•L-1•min-1
此反应在不同条件下进行最快的是( )
| A. | (1) | B. | (2) | C. | (3) | D. | (4) |
20.能正确表示下列化学反应的离子方程式是( )
| A. | 氢氧化钡溶液与硫酸的反应OH-+H+═H2O | |
| B. | 铁与稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 铜片插入硝酸银溶液中Cu+Ag+═Cu2++Ag | |
| D. | 金属钠与水反应:2Na+2H2O═2Na++2OH-+H2↑ |
7.下列有关物质组成的说法正确的是( )
| A. | 物质均是由分子构成,分子均是由原子构成的 | |
| B. | 某物质经测定,只含有一种组成元素,则该物质一定是单质 | |
| C. | 纯净的硫酸是纯净物,而不含杂质的盐酸是混合物 | |
| D. | 碱性氧化物均是金属氧化物,酸性氧化物均是非金属氧化物 |
17.用湿润的pH试纸测定溶液的pH,不变的是( )
| A. | HCl溶液 | B. | NaOH溶液 | C. | Na2SO4溶液 | D. | 氨水 |
4.Na2CO3的摩尔质量为106g•mol-1.将5.3gNa2CO3固体完全溶于稀盐酸后,再用蒸馏水稀释成100mL溶液.该溶液中Na+的物质的量浓度为( )
| A. | 5.0mol•L-1 | B. | 0.10mol•L-1 | C. | 1.0mol•L-1 | D. | 0.50mol•L-1 |
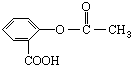 ,它可以接在一种高聚物载体上形成缓释长效药剂.其中的一种结构如下:
,它可以接在一种高聚物载体上形成缓释长效药剂.其中的一种结构如下: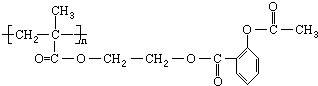
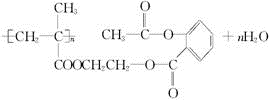
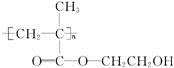 .
.
 .
. 的透光率良好,可制作车、船、飞机的挡风玻璃,以及眼睛镜片、光盘、唱片等.原来合成聚碳酸酯的一种原料是用有毒的光气(又称碳酰氯COCl2),现在改用绿色化学原料碳酸二甲酯
的透光率良好,可制作车、船、飞机的挡风玻璃,以及眼睛镜片、光盘、唱片等.原来合成聚碳酸酯的一种原料是用有毒的光气(又称碳酰氯COCl2),现在改用绿色化学原料碳酸二甲酯  与哪类物质缩合聚合而成( )
与哪类物质缩合聚合而成( )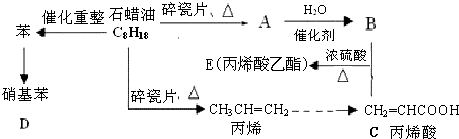
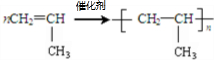 ;反应类型加聚反应.
;反应类型加聚反应.