题目内容
12.A、B、C、D、E、F六种元素,试按下列所给条件进行推断①A、B、C是同一周期的金属元素,原子核外有三个电子层,A的原子半径在所属周期中最大,且原子半径A>B>C
②D、E是非金属元素,它们跟氢气化合可生成气态氢化物HD和HE,室温时,D的单质是液体,E的单质是固体
③F是除氢和0族元素外原子半径最小的元素
(1)B位于周期表中的位置第三周期ⅡA族,C的原子结构示意图是

(2)A元素与D元素形成化合物的电子式是
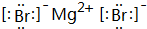
(3)在上述六种元素中,最高价氧化物对应的水化物碱性最强的化学式是NaOH,气态氢化物最稳定的是HF(填化学式)
(4)将C的氧化物对应的水化物投入到A的氧化物对应的水化物中,反应的化学方程式是Al(OH)3+NaOH=NaAlO2+2H2O.
(5)已知E的+5价含氧酸盐有强氧化性,能将其最低价态的简单离子在酸性条件下氧化成单质,写出其离子方程式5I-+IO3-+6H+=3I2+3H2O.
分析 A、B、C、D、E、F六种元素,①A、B、C是同一周期的金属元素,原子核外有三个电子层,处于第三周期,A的原子半径在所属周期中最大,则A为Na,且原子半径A>B>C,则B为Mg、C为Al;②D、E是非金属元素,它们跟氢气化合可生成气态氢化物HD和HE,处于ⅦA族,室温时,D的单质是液体,E的单质是固体,则D为Br、E为I;③F是除氢和0族元素外原子半径最小的元素,则F为氟元素,据此解答.
解答 解:A、B、C、D、E、F六种元素,①A、B、C是同一周期的金属元素,原子核外有三个电子层,处于第三周期,A的原子半径在所属周期中最大,则A为Na,且原子半径A>B>C,则B为Mg、C为Al;②D、E是非金属元素,它们跟氢气化合可生成气态氢化物HD和HE,处于ⅦA族,室温时,D的单质是液体,E的单质是固体,则D为Br、E为I;③F是除氢和0族元素外原子半径最小的元素,则F为氟元素,
(1)B为Mg,位于周期表中第三周期ⅡA族,C为Al元素,原子结构示意图是 ,
,
故答案为:第三周期ⅡA族; ;
;
(2)A元素与D元素形成化合物为MgBr2,电子式是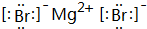 ,
,
故答案为: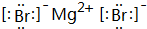 ;
;
(3)在上述六种元素中,Na的金属性最强,故最高价氧化物对应的水化物碱性最强的是NaOH,F元素非金属性最强,气态氢化物最稳定的是HF,
故答案为:NaOH;HF;
(4)C的氧化物对应的水化物为Al(OH)3,A的氧化物对应的水化物为NaOH,二者反应生成偏铝酸钠与水,反应的化学方程式是:Al(OH)3+NaOH=NaAlO2+2H2O,
故答案为:Al(OH)3+NaOH=NaAlO2+2H2O;
(5)E的+5价含氧酸盐有强氧化性,能将其最低价态的简单离子在酸性条件下氧化成单质,其离子方程式为:5I-+IO3-+6H+=3I2+3H2O,
故答案为:5I-+IO3-+6H+=3I2+3H2O.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,侧重对化学用语的考查,难度不大.

| A. | ${\;}_{53}^{135}$I是碘的一种同素异形体 | |
| B. | ${\;}_{53}^{135}$I位于元素周期表中第5周期ⅦA族 | |
| C. | ${\;}_{53}^{135}$I是一种新发现的元素 | |
| D. | ${\;}_{53}^{135}$I核内的中子数与核外电子数之差为29 |
| A. | 电解水若生成33.6L(标准状况)气体时电路中通过的电子数目为2NA | |
| B. | 5NH4NO3=2HNO3+4N2↑+9H2O反应中,生成56gN2时,转移电子数目为7.5NA | |
| C. | 用2mL5mol/L的FeCl3溶液制成的氢氧化铁胶体中所含胶粒数为0.01NA | |
| D. | 56g铁片投入足量浓H2SO4中生成NA个SO2分子 |
| 选项 | 实验目的 | 操作 |
| A | 从溴水中提取单质溴 | 先用CCl4 萃取分液后,再蒸馏 |
| B | 证明 Mg(OH)2沉淀可以转化为Fe(OH)3沉淀 | 向2mL1mol•L-1NaOH溶液中先加入3滴1mol•L-1MgCl2溶液,再加入3滴1mol•L-1FeCl3 溶液 |
| C | 验证蔗糖是否水解生成葡萄糖 | 向蔗糖溶液中加入少量稀硫酸加热,再加入少量NaOH溶液,调至碱性,然后加银氨溶液水浴加热 |
| D | 证明碱的非金属性强于硅 | 向NaSiO3溶液中通入适量CO2 气体,有白色胶状沉淀生成 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 新能源汽车的推广与使用有助于减少光化学烟雾的产生 | |
| B. | 为了防止月饼等富脂食品氧化变质,常在包装袋中放入生石灰 | |
| C. | “碳纳米泡沫”倍称为第五形态的单质碳,它与石墨弧称为同位素 | |
| D. | 海水淡化能解决淡水供应危机,向海水中加入净水剂明矾可以使海水淡化 |
| A. | CH3CH2CH2CH3 | B. | CH3-CH=CHCH3 | C. | HC≡C-CH2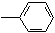 | D. | CH3-C≡C-C≡C-CH3 |
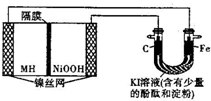 如图中的左侧装置是一种金属氢化物镍电池,其中的MH是吸附了氢原子的储氢合金,电解质溶液KOH.右侧装置是一电解池,电极材料及电解质溶液如图所示,下列有关此实验的叙述中,正确的是( )
如图中的左侧装置是一种金属氢化物镍电池,其中的MH是吸附了氢原子的储氢合金,电解质溶液KOH.右侧装置是一电解池,电极材料及电解质溶液如图所示,下列有关此实验的叙述中,正确的是( )| A. | 放电时负极反应为:MH+OH-=M+H2O+e- | |
| B. | 充电时隔膜旁的OH-从右向左移动 | |
| C. | 右侧装置中的铁电极附近溶液呈蓝色 | |
| D. | 右侧装置中的碳电极表面逸出无色、无味的气体 |
| A. | 其它条件不变,增大压强,平衡不发生移动 | |
| B. | 该反应式中n值一定为2 | |
| C. | 其它条件不变,增大压强,混合气体的总质量不变 | |
| D. | 原混合气中A与B的物质的量之比为2:1,且2M(A)+M(B)=3M(D)(其中M表示物质的摩尔质量) |
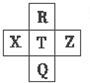 元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,其中R单质在暗处与H2 剧烈化合并发生爆炸.则下列判断正确的是( )
元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,其中R单质在暗处与H2 剧烈化合并发生爆炸.则下列判断正确的是( )| A. | 最高价氧化物对应的水化物的酸性:X<T<Q | |
| B. | 由于键能EH-R>EH-T,故元素R、T对应气态氢化物的沸点:HR>HT | |
| C. | R与Q的电子数相差16 | |
| D. | 元素R对应气态氢化物的相对分子质量实际测量值往往比理论上要大的多,这可能和氢键有关 |