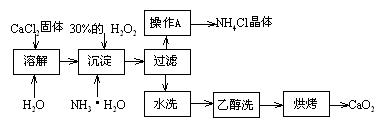
题目内容
有一瓶白色固体,取少量置于试管中加热,固体逐渐消失,放出水蒸气和其他两种气体,试管内除管口有少量水珠外,没有任何残留物。取0.350g这种固体跟过量的碱液反应,生成一种能使湿润红色石蕊试纸变蓝的气体,这些气体正好能和30.0mL 0.100mol/L H2SO4完全反应;另取0.350g该固体跟足量盐酸反应,放出一种无色、无臭的气体,将这些气体通入过量的澄清石灰水中,得到0.400g白色沉淀。
(1)计算0.350g固体中含有的阴离子和阳离子的物质的量。
(2)根据实验及计算结果确定白色固体是什么?写出判断的依据。
答案:
解析:
解析:
(1)从固体与碱液共热时放出能使湿润红色石蕊试纸变蓝的气体,证明有NH4+存在,从固体与酸反应所生成的气体能与石灰水作用产生白色沉淀,证实固体中有CO n( n(NH4+) = 2×0.003 = 0.006(mol)。 (2)从固体加热分解后,试管内没有任何残留物,以及生成除水蒸气之外只有两种气体,说明该固体中不含任何固体金属离子和其他酸根离子。所以该固体可能是(NH4)2CO3和NH4HCO3。 在(NH4)2CO3中,NH4+和CO32-的物质的量之比为2∶1;在NH4HCO3中,NH4+和HCO3-的物质的量之比为1∶1;该固体中,NH4+和CO
|

练习册系列答案
 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案
相关题目