题目内容
高铁酸钠(Na2FeO4)是一种新型、高效、多功能水处理剂,是比Cl2、O3、ClO2、KMnO4氧化性更强、无二次污染的绿色水处理剂.工业制高铁酸钠的方法有如下两种:
湿法制备的主要离子反应为:2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O,
干法制备的主要反应方程为:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑
则下列有关说法正确的是( )
湿法制备的主要离子反应为:2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O,
干法制备的主要反应方程为:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑
则下列有关说法正确的是( )
| A.高铁酸钾中铁显+6价 |
| B.湿法中FeO42-是还原产物 |
| C.干法中每生成1mol Na2FeO4 转移4mol电子 |
| D.K2FeO4可氧化水中的H2S、NH3,生成的Fe(OH)3胶体还能吸附悬浮杂质 |
A、根据高铁酸钾的化学式(K2FeO4)可知,设铁元素的化合价为x,则+1×2+x+(-2)×4=0,解得x=+6,故A正确;
B、湿法中FeO42-是氧化产物,故B错误;
C、反应2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑中,铁元素化合价升高,每生成2molNa2FeO4,转移电子总数=化合价升高总数=化合价降低总数=8mol,所以每生成1molNa2FeO4共转移4mol电子,同时1molNa2O2变化生成1molO2,化合价升高,转移电子物质的量为2mol,所以共转移电子10mol,故C错误;
D、K2FeO4具有氧化性所以能杀菌,H2S、NH3具有还原性被氧化,高铁酸钾与水反应时生成的Fe(OH)3(胶体)具有净水作用,故D正确;
故选AD.
B、湿法中FeO42-是氧化产物,故B错误;
C、反应2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑中,铁元素化合价升高,每生成2molNa2FeO4,转移电子总数=化合价升高总数=化合价降低总数=8mol,所以每生成1molNa2FeO4共转移4mol电子,同时1molNa2O2变化生成1molO2,化合价升高,转移电子物质的量为2mol,所以共转移电子10mol,故C错误;
D、K2FeO4具有氧化性所以能杀菌,H2S、NH3具有还原性被氧化,高铁酸钾与水反应时生成的Fe(OH)3(胶体)具有净水作用,故D正确;
故选AD.

练习册系列答案
相关题目
用高铁酸钠(Na2FeO4)对河湖水消毒是城市饮水处理的新技术,制取Na2FeO4的反应为:Fe2O3+3Na2O2═2Na2FeO4+Na2O,下列说法不正确的是( )
| A、Fe2O3是反应的还原剂 | B、Na2O2既是氧化剂又是还原剂 | C、Na2FeO4反应的氧化产物 | D、Na2FeO4能消毒杀菌是因其具有强氧化性 |


 (2011?福建模拟)一定条件下铁可以和CO2发生反应:
(2011?福建模拟)一定条件下铁可以和CO2发生反应: FeO(s)+CO(g);△H>0
FeO(s)+CO(g);△H>0

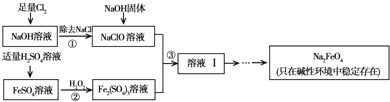
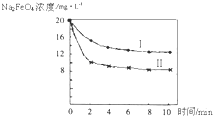 (2012?朝阳区一模)高铁酸钠(Na2FeO4)具有很强的氧化性,是一种新型的绿色净水消毒剂.工业上可以通过次氯酸钠氧化法制备高铁酸钠,生产过程如下:
(2012?朝阳区一模)高铁酸钠(Na2FeO4)具有很强的氧化性,是一种新型的绿色净水消毒剂.工业上可以通过次氯酸钠氧化法制备高铁酸钠,生产过程如下: