题目内容
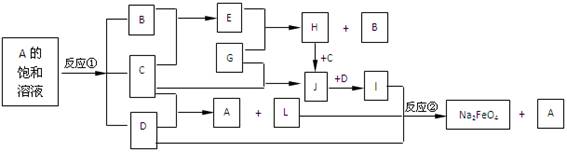
下图中的反应①是重要的电化学工业反应,反应②可用于制备新型消毒净水剂Na2FeO4.常温下B、C为气态单质,G是当代社会使用量最大的金属,其余均为化合物.(反应时加入或生成的水,以及生成沉淀I时的其他产物均已略去).

请回答下列问题:
(1)E的电子式为
 .
.
(2)J溶液蒸干灼烧得到的物质是(填化学式)
(3)反应①的化学方程式是
(4)反应②的离子方程式是
(5)高铁酸钠(Na2FeO4)是一种新型、高效、无二次污染的绿色水处理剂.工业上干法制备高铁酸钠的主要反应方程式为:FeSO4+Na2O2→Na2FeO4+Na2O+Na2SO4+O2↑(未配平)
下列有关说法不正确的是
A.高铁酸钠中铁显+6价
B.干法中每生成1mol Na2FeO4转移4mol电子
C.Na2FeO4处理水时,不仅能消毒杀菌,还能除去水体中的H2S、NH3等
D.Na2FeO4处理水时还能吸附水中的悬浮杂质,所以自来水厂用高铁酸钠处理水后无需再用活性炭处理了.

请回答下列问题:
(1)E的电子式为


(2)J溶液蒸干灼烧得到的物质是(填化学式)
Fe2O3
Fe2O3
.(3)反应①的化学方程式是
2NaCl+2H2O
2NaOH+H2↑+Cl2↑
| ||
2NaCl+2H2O
2NaOH+H2↑+Cl2↑
.
| ||
(4)反应②的离子方程式是
2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O
2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O
.(5)高铁酸钠(Na2FeO4)是一种新型、高效、无二次污染的绿色水处理剂.工业上干法制备高铁酸钠的主要反应方程式为:FeSO4+Na2O2→Na2FeO4+Na2O+Na2SO4+O2↑(未配平)
下列有关说法不正确的是
BD
BD
A.高铁酸钠中铁显+6价
B.干法中每生成1mol Na2FeO4转移4mol电子
C.Na2FeO4处理水时,不仅能消毒杀菌,还能除去水体中的H2S、NH3等
D.Na2FeO4处理水时还能吸附水中的悬浮杂质,所以自来水厂用高铁酸钠处理水后无需再用活性炭处理了.
分析:反应①是重要的电化学工业反应,且是A的饱和溶液发生的电化学反应,工业上用电解饱和水的方法制取氯气,所以A是氯化钠,电解氯化钠溶液生成氯气、氢气和氢氧化钠,常温下B、C为气态单质,所以D是氢氧化钠;氯气能和氢氧化钠反应,而氢气不和氢氧化钠反应,所以C是氯气,B是氢气;氢气和氯气反应生成氯化氢,所以E是氯化氢;G是当代社会使用量最大的金属,所以G是铁,氯气和铁反应生成氯化铁,所以J是氯化铁;盐酸和铁反应生成氯化亚铁,所以H是氯化亚铁;氯化铁和氢氧化钠反应生成氢氧化铁,氢氧化钠和氯化铁、L反应生成Na2FeO4和氯化钠,氢氧化铁所还原剂,所以还需要氧化剂,且不生成新的杂质,所以L是次氯酸盐.
(1)氯化氢是共价化合物,根据共价化合物的电子式的书写方式书写;
(2)根据氯化铁的性质、氢氧化铁的性质确定最终产物;
(3)电解饱和氯化钠溶液生成氯气、氢气和氢氧化钠;
(4)氢氧化铁和次氯酸盐、氢氧根离子反应生成铁酸根离子、氯离子和水;
(5)A、根据化合物中各种元素的化合价代数和为0确定铁元素的化合价;
B、根据铁酸钠和转移电子之间的关系式计算;
C、根据铁酸钠的性质判断;
D、铁酸钠具有强氧化性,没有吸附性.
(1)氯化氢是共价化合物,根据共价化合物的电子式的书写方式书写;
(2)根据氯化铁的性质、氢氧化铁的性质确定最终产物;
(3)电解饱和氯化钠溶液生成氯气、氢气和氢氧化钠;
(4)氢氧化铁和次氯酸盐、氢氧根离子反应生成铁酸根离子、氯离子和水;
(5)A、根据化合物中各种元素的化合价代数和为0确定铁元素的化合价;
B、根据铁酸钠和转移电子之间的关系式计算;
C、根据铁酸钠的性质判断;
D、铁酸钠具有强氧化性,没有吸附性.
解答:解:反应①是重要的电化学工业反应,且是A的饱和溶液发生的电化学反应,工业上用电解饱和水的方法制取氯气,所以A是氯化钠,电解氯化钠溶液生成氯气、氢气和氢氧化钠,常温下B、C为气态单质,所以D是氢氧化钠;氯气能和氢氧化钠反应,而氢气不和氢氧化钠反应,所以C是氯气,B是氢气;氢气和氯气反应生成氯化氢,所以E是氯化氢;G是当代社会使用量最大的金属,所以G是铁,氯气和铁反应生成氯化铁,所以J是氯化铁;盐酸和铁反应生成氯化亚铁,所以H是氯化亚铁;氯化铁和氢氧化钠反应生成氢氧化铁,氢氧化钠和氯化铁、L反应生成Na2FeO4和氯化钠,氢氧化铁所还原剂,所以还需要氧化剂,且不生成新的杂质,所以L是次氯酸盐.
(1)氯化氢的电子式为: ,故答案为:
,故答案为: ;
;
(2)加热氯化铁溶液时,氯化铁水解生成氢氧化铁和盐酸,盐酸有挥发性,导致促进氯化铁的水解;当蒸干灼烧氢氧化铁时,氢氧化铁分解生成氧化铁和水蒸气,
所以剩余的固体是Fe2O3,故答案为:Fe2O3;
(3)电解饱和氯化钠溶液生成氯气、氢气和氢氧化钠,电解反应式为:2NaCl+2H2O
2NaOH+H2↑+Cl2↑,
故答案为:2NaCl+2H2O
2NaOH+H2↑+Cl2↑;
(4)碱性条件下,氢氧化铁和次氯酸根离子反应生成铁酸根离子、氯离子和水,反应方程式为:2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O,
故答案为:2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O;
(5)A、根据高铁酸钾的化学式(K2FeO4)可知,设铁元素的化合价为x,则+1×2+x+(-2)×4=0,解得x=+6,故A正确;
B、干法中发生反应2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,每生成2molNa2FeO4,转移电子数=化合价升高数=化合价降低数=10mol,所以每生成1molNa2FeO4共转移5mol电子,故B错误;
C、铁酸钠有强氧化性,所以能杀菌消毒,能氧化强还原性的物质,如氨气和硫化氢,故C正确;
D、Na2FeO4具有氧化性所以能杀菌,高铁酸钠与水反应时生成的Fe(OH)3(胶体)具有净水作用,但铁酸钠没有吸附色素、异味的作用,故D错误;
故选BD.
(1)氯化氢的电子式为:
 ,故答案为:
,故答案为: ;
;(2)加热氯化铁溶液时,氯化铁水解生成氢氧化铁和盐酸,盐酸有挥发性,导致促进氯化铁的水解;当蒸干灼烧氢氧化铁时,氢氧化铁分解生成氧化铁和水蒸气,
所以剩余的固体是Fe2O3,故答案为:Fe2O3;
(3)电解饱和氯化钠溶液生成氯气、氢气和氢氧化钠,电解反应式为:2NaCl+2H2O
| ||
故答案为:2NaCl+2H2O
| ||
(4)碱性条件下,氢氧化铁和次氯酸根离子反应生成铁酸根离子、氯离子和水,反应方程式为:2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O,
故答案为:2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O;
(5)A、根据高铁酸钾的化学式(K2FeO4)可知,设铁元素的化合价为x,则+1×2+x+(-2)×4=0,解得x=+6,故A正确;
B、干法中发生反应2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,每生成2molNa2FeO4,转移电子数=化合价升高数=化合价降低数=10mol,所以每生成1molNa2FeO4共转移5mol电子,故B错误;
C、铁酸钠有强氧化性,所以能杀菌消毒,能氧化强还原性的物质,如氨气和硫化氢,故C正确;
D、Na2FeO4具有氧化性所以能杀菌,高铁酸钠与水反应时生成的Fe(OH)3(胶体)具有净水作用,但铁酸钠没有吸附色素、异味的作用,故D错误;
故选BD.
点评:本题以物质的推断为载体考查了元素化合物的性质,能正确推断元素是解本题的关键,注意胶体具有吸附悬浮物的作用,但没有吸附色素和异味的作用.

练习册系列答案
相关题目