题目内容
12.生活中处处有化学,应用物质性质对下列物质用途的解释不正确的是( )| A | B | C | D | |
| 用途 | 热的纯碱溶液可去油污 | 明矾可用于净水 | 抗坏血酸(Vc)可作抗氧化剂 | 液氨可做制冷剂 |
| 解释 | 纯碱水解呈碱性 | 明矾在水中生成的氢氧化铝胶体有吸附性 | Vc具有酸性 | 液氨汽化时吸收大量的热 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.碳酸钠为强碱弱酸盐,水解显碱性;
B.铝离子水解生成氢氧化铝胶体,具有吸附性,能够吸附水中的杂质粒子;
C.抗氧化剂应据有还原性;
D.液氨汽化吸收大量的热.
解答 解:A.碳酸钠为强碱弱酸盐,水解显碱性,加热促进碳酸钠水解,碱性增强,油脂在碱性条件下水解彻底,故A正确;
B.明矾电离产生的铝离子水解生成具有吸附性的氢氧化铝胶体,能够吸附水中的杂质粒子,起到净水的作用,故B正确;
C.抗坏血酸(Vc)可作抗氧化剂,所以Vc具有还原性,故C错误;
D.液氨汽化吸收大量的热,可使环境温度降低,能够做制冷剂,故D正确;
故选:C.
点评 本题考查了物质的性质和用途之间的关系,明确物质的性质是解题关键,注意明矾净水的原理,为热门考点.

练习册系列答案
相关题目
2. 一定条件下,固定容积的密闭容器中,CO和H2反应生成甲醇:CO(g)+2H2(g)?CH3OH(g).如图是该反应在不同温度下CO的转化率随时间变化的曲线.下列判断正确的是( )
一定条件下,固定容积的密闭容器中,CO和H2反应生成甲醇:CO(g)+2H2(g)?CH3OH(g).如图是该反应在不同温度下CO的转化率随时间变化的曲线.下列判断正确的是( )
 一定条件下,固定容积的密闭容器中,CO和H2反应生成甲醇:CO(g)+2H2(g)?CH3OH(g).如图是该反应在不同温度下CO的转化率随时间变化的曲线.下列判断正确的是( )
一定条件下,固定容积的密闭容器中,CO和H2反应生成甲醇:CO(g)+2H2(g)?CH3OH(g).如图是该反应在不同温度下CO的转化率随时间变化的曲线.下列判断正确的是( )| A. | T1>T2,该反应的△H>0 | |
| B. | 加入催化剂可以提高CO的转化率 | |
| C. | T1时的平衡常数K1>T2时的平衡常数K2 | |
| D. | CO(g)+2H2(g)?CH3OH(1)的△H值将变大 |
3. 电渗析法是一种利用A、B离子交换膜进行海水淡化的方法,其原理如图所示.已知海水中含Na+、Cl-、Ca2+、Mg2+、SO42-等离子,电极为惰性电极.下列叙述中正确的是( )
电渗析法是一种利用A、B离子交换膜进行海水淡化的方法,其原理如图所示.已知海水中含Na+、Cl-、Ca2+、Mg2+、SO42-等离子,电极为惰性电极.下列叙述中正确的是( )
 电渗析法是一种利用A、B离子交换膜进行海水淡化的方法,其原理如图所示.已知海水中含Na+、Cl-、Ca2+、Mg2+、SO42-等离子,电极为惰性电极.下列叙述中正确的是( )
电渗析法是一种利用A、B离子交换膜进行海水淡化的方法,其原理如图所示.已知海水中含Na+、Cl-、Ca2+、Mg2+、SO42-等离子,电极为惰性电极.下列叙述中正确的是( )| A. | 是原电池装置,把化学能转化为电能 | |
| B. | 是电解装置,只发生物理变化 | |
| C. | 左右池中得到淡水 | |
| D. | A膜是阴离子交换膜,B膜是阳离子交换膜 |
20.下列实验、现象及相关结论均正确的是( )
| A | B | C | D | |
| 实验 | 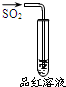 | 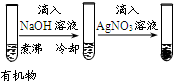 |  | 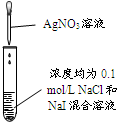 |
| 现象 | 品红褪色 | 最后试管有浅黄色沉淀 | 最后一滴溶液使酚酞由无色变为粉红色,且30秒不复原 | 出现白色沉淀 |
| 结论 | SO2有强氧化性 | 有机物中含有溴原子 | 滴定达到终点 | Ksp(AgCl)>Ksp(AgI) |
| A. | A | B. | B | C. | C | D. | D |
7.LED产品的使用为城市增添色彩.如图是氢氧燃料电池驱动LED发光的一种装置示意图.下列有关叙述正确的是( )
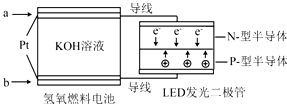

| A. | b处通入H2 | |
| B. | 该装置将化学能最终转化为电能 | |
| C. | 通入H2的电极发生反应:2H2-4e-=4H+ | |
| D. | a处为电池负极,发生了氧化反应 |
4.下列说法正确的是( )
| A. | 将少量的溴水滴入FeCl2、NaI的混合溶液中,再滴加CCl4,振荡、静置,下层溶液呈紫红色,说明氧化性:Br2>Fe3+>I2 | |
| B. | 已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=-57.3 kJ•mol-1,则含40.0 g NaOH的稀溶液与稀醋酸完全中和,放出57.3 kJ的热量 | |
| C. | 常温下,0.1 mol•L-1某一元酸HA溶液中$\frac{c(O{H}^{-})}{c({H}^{+})}$=1×10-12,溶液中加入一定量NaA晶体或加水稀释,溶液中c(OH-)均增大 | |
| D. | 取久置的Na2O2粉末,向其中滴加过量的盐酸,产生无色气体,不能说明Na2O2是否变质 |
1.醋酸异丁酯(a)和香豆素(b)均是用途广泛的香料,下列有关说法正确的是( )

| A. | a属于不饱和烃 | |
| B. | a、b含有的官能团种类相同 | |
| C. | 1molb最多能和4molH2反应 | |
| D. | 等物质的量的a、b最多消耗NaOH的量相同 |
8.能发生消去反应,且有机产物有两种的是( )
| A. | CH3-Cl | B. | CH3CHBrCH3 | C. | CH3CH2CHBrCH3 | D. | 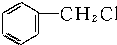 |
