题目内容
 X、Y、Z、W都是中学化学常见的物质,其中X、Y、Z均含有同一种元素.在一定条件下相互转化的关系如图所示(部分反应中的H2O已略去).请按要求回答下列问题:
X、Y、Z、W都是中学化学常见的物质,其中X、Y、Z均含有同一种元素.在一定条件下相互转化的关系如图所示(部分反应中的H2O已略去).请按要求回答下列问题:(1)若X可用于自来水消毒,W为金属单质,且W是用量最大、用途最广的金属,若加热蒸干Y的溶液没有得到Y的盐,则反应③的离子方程式为
(2)若X常用作制冷剂,Y和W为空气的主要成分,则反应③的化学方程式为 4NH3+6NO=5N2+6H2O.
(3)若W为氯碱工业的重要产品,Y有两性,反应③的离子方程式可以是
(4)若X、Z、W都是常见气体,Z是形成酸雨的主要气体,则反应③的化学方程式为
考点:无机物的推断
专题:推断题
分析:(1)若X可用于自来水消毒,应为Cl2,W为金属单质,且W是用量最大、用途最广的金属,应为Fe,Y为FeCl3,Z为FeCl2;
(2)X用作制冷剂,则X是氨气,Y和W为空气的主要成分,W是氧气,Y是氮气,Z为NO;
(3)若W为氯碱工业的重要产品,Y有两性,由转化关系可知W为NaOH,Y为Al(OH)3,X含有Al3+,Z含有AlO2-;
(4)Z是形成酸雨的主要气体,应为SO2,则X为H2SH2S,W为SO2,Y为S.
(2)X用作制冷剂,则X是氨气,Y和W为空气的主要成分,W是氧气,Y是氮气,Z为NO;
(3)若W为氯碱工业的重要产品,Y有两性,由转化关系可知W为NaOH,Y为Al(OH)3,X含有Al3+,Z含有AlO2-;
(4)Z是形成酸雨的主要气体,应为SO2,则X为H2SH2S,W为SO2,Y为S.
解答:
解:(1)若X可用于自来水消毒,应为Cl2,W为金属单质,且W是用量最大、用途最广的金属,应为Fe,Y为FeCl3,Z为FeCl2,反应③的离子方程式为2Fe2++Cl2=2Fe3++2 Cl-,
故答案为:2Fe2++Cl2=2Fe3++2Cl-;
(2)X用作制冷剂,则X是氨气,Y和W为空气的主要成分,W是氧气,Y是氮气,Z为NO,反应③的化学方程式为4NH3+6NO=5N2+6H2O,
故答案为:4NH3+6NO=5N2+6H2O;
(3)若W为氯碱工业的重要产品,Y有两性,由转化关系可知W为NaOH,Y为Al(OH)3,X含有Al3+,Z含有AlO2-或[Al(OH)4]-,反应③的离子方程式可以是Al3++3[Al(OH)4]-=4Al(OH)3↓或Al3++3 AlO2-+6H2O=4Al(OH)3↓,通过氯碱工业制取W的化学方程式为2NaCl+2H2O
2NaOH+H2↑+Cl2↑,
故答案为:Al3++3[Al(OH)4]-=4Al(OH)3↓或Al3++3 AlO2-+6H2O=4Al(OH)3↓;2NaCl+2H2O
2NaOH+H2↑+Cl2↑;
(4)Z是形成酸雨的主要气体,应为SO2,则X为H2SH2S,W为SO2,Y为S,反应③的化学方程式为2H2S+SO2=3S+2H2O,
故答案为:2H2S+SO2=3S+2H2O.
故答案为:2Fe2++Cl2=2Fe3++2Cl-;
(2)X用作制冷剂,则X是氨气,Y和W为空气的主要成分,W是氧气,Y是氮气,Z为NO,反应③的化学方程式为4NH3+6NO=5N2+6H2O,
故答案为:4NH3+6NO=5N2+6H2O;
(3)若W为氯碱工业的重要产品,Y有两性,由转化关系可知W为NaOH,Y为Al(OH)3,X含有Al3+,Z含有AlO2-或[Al(OH)4]-,反应③的离子方程式可以是Al3++3[Al(OH)4]-=4Al(OH)3↓或Al3++3 AlO2-+6H2O=4Al(OH)3↓,通过氯碱工业制取W的化学方程式为2NaCl+2H2O
| ||
故答案为:Al3++3[Al(OH)4]-=4Al(OH)3↓或Al3++3 AlO2-+6H2O=4Al(OH)3↓;2NaCl+2H2O
| ||
(4)Z是形成酸雨的主要气体,应为SO2,则X为H2SH2S,W为SO2,Y为S,反应③的化学方程式为2H2S+SO2=3S+2H2O,
故答案为:2H2S+SO2=3S+2H2O.
点评:本题考查较为综合,涉及元素化合物的推断,为高频考点,侧重于学生的分析能力,物质性质是解题关键,题目具有一定难度,做题时注意把握推断的思路.

练习册系列答案
相关题目
推断乙酰水杨酸(如图)不具有的化学性质( )


| A、与NaOH溶液反应 |
| B、水解反应 |
| C、与乙酸发生酯化反应 |
| D、与乙醇发生酯化反应 |
关于反应2Fe3++Cu═2Fe2++Cu2+说法不正确的是( )
| A、该反应中Fe3+是氧化剂 |
| B、该反应中Cu被氧化了 |
| C、2mol Fe3+反应后共得到4NA个电子 |
| D、氧化产物与还原产物的物质的量之比为1:2 |
下列物质中,属于合金的是( )
| A、金 | B、不锈钢 | C、金属铝 | D、铜 |

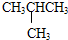
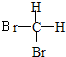 和
和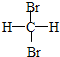 E.CH4和CH3(CH2)2CH3
E.CH4和CH3(CH2)2CH3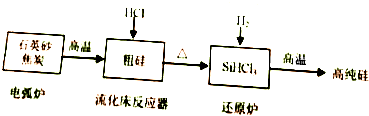 硅在地壳中的含量较高.硅及其化合物的开发由来已久,在现代生活中有广泛应用,回答下列问题:
硅在地壳中的含量较高.硅及其化合物的开发由来已久,在现代生活中有广泛应用,回答下列问题: 化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题:
化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题: