题目内容
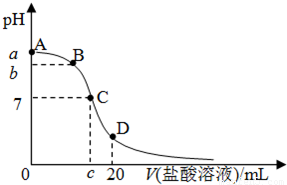
25℃,在20mL 0.1mol/L 氨水溶液中逐滴加入0.2mol/LHCl溶液(如图),下列说法正确的是( )
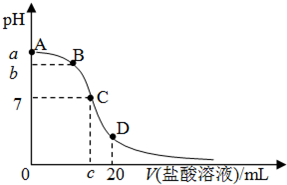
| A.在A、C间任一点,溶液中一定都有:c(NH4+)>c(Cl-)>c(OH-)>c(H+) |
| B.在C点,c<10,且有c(NH4+)=c(Cl-)=c(OH-)=c(H+) |
| C.若25℃时 0.1mol/L 氨水电离度为1.33%,则b<a<12 |
| D.在D点:2c(NH4+)+2c(NH3?H2O)=c(Cl-) |

A、在A、C间任一点,当盐酸的量很少时,溶液中以氨水的电离为主,所以溶液中离子存在的关系可能是c(NH4+)>c(OH-)>c(Cl-)>c(H+),故A错误.
B、氯化铵是强酸弱碱盐,其水溶液呈酸性,当溶液的PH=7时,氨水的量应稍微过量,所以盐酸的体积小于10mL;溶液呈中性导致c(OH-)=c(H+),根据溶液呈电中性得c(NH4+)=c(Cl-),溶液是氯化铵溶液所以各种离子的关系为
c(NH4+)=c(Cl-)>c(OH-)=c(H+),故B错误.
C、25℃时 0.1mol/L 氨水电离度为1.33%,0.1mol/L 氨水溶液中氢氧根离子的物质的量浓度=1.33×10-3 mol/L,所以溶液的PH<12,向氨水中加入盐酸时,发生酸碱中和反应导致溶液的PH值降低;所以b<a<12,故C正确.
D、在D点时,根据物料守恒知,n(NH3?H2O)+n(NH4+)=0.002mol,n(Cl-)=0.004mol,溶液的体积相同,
所以2c(NH4+)+2c(NH3?H2O)=c(Cl-),故D正确.
故选CD.
B、氯化铵是强酸弱碱盐,其水溶液呈酸性,当溶液的PH=7时,氨水的量应稍微过量,所以盐酸的体积小于10mL;溶液呈中性导致c(OH-)=c(H+),根据溶液呈电中性得c(NH4+)=c(Cl-),溶液是氯化铵溶液所以各种离子的关系为
c(NH4+)=c(Cl-)>c(OH-)=c(H+),故B错误.
C、25℃时 0.1mol/L 氨水电离度为1.33%,0.1mol/L 氨水溶液中氢氧根离子的物质的量浓度=1.33×10-3 mol/L,所以溶液的PH<12,向氨水中加入盐酸时,发生酸碱中和反应导致溶液的PH值降低;所以b<a<12,故C正确.
D、在D点时,根据物料守恒知,n(NH3?H2O)+n(NH4+)=0.002mol,n(Cl-)=0.004mol,溶液的体积相同,
所以2c(NH4+)+2c(NH3?H2O)=c(Cl-),故D正确.
故选CD.

练习册系列答案
 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案
相关题目
 25℃,在20mL 0.1mol?L-1氨水溶液中逐滴加入0.1mol?L-1HCl溶液,其pH与所加盐酸溶液体积(V/mL)的关系如图所示,下列说法正确的是( )
25℃,在20mL 0.1mol?L-1氨水溶液中逐滴加入0.1mol?L-1HCl溶液,其pH与所加盐酸溶液体积(V/mL)的关系如图所示,下列说法正确的是( )| A、在D点:c(NH4+)+c(NH3?H2O)=c(Cl-) | B、在C点,V1<10,且有c(NH4+)=c(Cl-)=c(OH-)=c(H+) | C、在A、C间任一点,溶液中一定都有:c(NH4+)>c(Cl-)>c(OH-)>c(H+) | D、已知25℃时 0.1 mol?L-1氨水电离度为1.33%,则b<a<12 |
下列说法中,正确的是( )
| A、已知25℃时NH4CN水溶液显碱性,则25℃时的电离常数K(NH3?H2O)>K(HCN) | B、25℃时,Mg(OH)2固体在20 mL 0.01mol?L-1氨水中的Ksp比在20mL 0.01mol?L-1 NH4Cl溶液中的Ksp小 | C、pH试纸测得新制氯水的pH为4.5 | D、FeCl3溶液和Fe2(SO4)3溶液加热蒸干、灼烧都得到Fe2O3 |
 (2011?常州三模)25℃,在20mL 0.1mol/L 氨水溶液中逐滴加入0.2mol/LHCl溶液(如图),下列说法正确的是( )
(2011?常州三模)25℃,在20mL 0.1mol/L 氨水溶液中逐滴加入0.2mol/LHCl溶液(如图),下列说法正确的是( )