题目内容
高铁酸钾(K2FeO4)具有极强的氧化性,是一种优良的水处理剂.
(1)FeO42-与水反应的方程式为:4FeO42-+10H2O?4Fe(OH)3+8OH-+3O2,K2FeO4在处理水的过程中所起的作用是
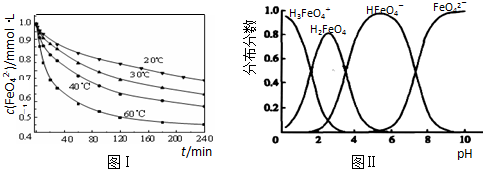
(2)将适量K2FeO4配制成c(FeO42-)=1.0×10-3mol?L-1(1.0mmol?L-1)的试样,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,测定c(FeO42-)的变化,结果见图Ⅰ.题(1)中的反应为FeO42-变化的主反应,该反应的△H
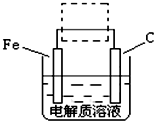
(3)FeO42-在水溶液中的存在形态如图Ⅱ所示.下列说法正确的是
A.不论溶液酸碱性如何变化,铁元素都有4种存在形态
B.改变溶液的pH,当溶液由pH=10降至pH=4的过程中,HFeO4-的分布分数先增大后减小
C.向pH=8的这种溶液中加KOH溶液,发生反应的离子方程式为:H2FeO4+OH-=HFeO4-+H2O
D.pH约为2.5 时,溶液中H3FeO4+和HFeO4-比例相当
(4)HFeO4-?H++FeO42-的电离平衡常数表达式为K=
,其数值接近
A.10-2.5;B.10-6;C.10-7;D.10-10
(5)25℃时,CaFeO4的Ksp=4.536×10-9,若要使100mL,1.0×10-3mol?L-1的K2FeO4溶液中的c(FeO42- )完全沉淀,理论上至少要加入的Ca(OH)2的物质的量为
(1)FeO42-与水反应的方程式为:4FeO42-+10H2O?4Fe(OH)3+8OH-+3O2,K2FeO4在处理水的过程中所起的作用是
杀菌消毒
杀菌消毒
和吸附悬浮物
吸附悬浮物
.(2)将适量K2FeO4配制成c(FeO42-)=1.0×10-3mol?L-1(1.0mmol?L-1)的试样,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,测定c(FeO42-)的变化,结果见图Ⅰ.题(1)中的反应为FeO42-变化的主反应,该反应的△H
>
>
0.(3)FeO42-在水溶液中的存在形态如图Ⅱ所示.下列说法正确的是
BD
BD
(填字母).A.不论溶液酸碱性如何变化,铁元素都有4种存在形态
B.改变溶液的pH,当溶液由pH=10降至pH=4的过程中,HFeO4-的分布分数先增大后减小
C.向pH=8的这种溶液中加KOH溶液,发生反应的离子方程式为:H2FeO4+OH-=HFeO4-+H2O
D.pH约为2.5 时,溶液中H3FeO4+和HFeO4-比例相当
(4)HFeO4-?H++FeO42-的电离平衡常数表达式为K=
| c(H+).c(FeO42-) |
| c(HFeO4-) |
| c(H+).c(FeO42-) |
| c(HFeO4-) |
C
C
(填字母).A.10-2.5;B.10-6;C.10-7;D.10-10
(5)25℃时,CaFeO4的Ksp=4.536×10-9,若要使100mL,1.0×10-3mol?L-1的K2FeO4溶液中的c(FeO42- )完全沉淀,理论上至少要加入的Ca(OH)2的物质的量为
4.536×10-5
4.536×10-5
mol,[完全沉淀后溶液中残留的c(FeO42- )为1×10-5mol/L
1×10-5mol/L
.
分析:(1)高铁酸钾(K2FeO4)具有极强的氧化性,是一种优良的水处理剂,起到杀菌消毒作用,形成胶体具有吸附悬浮杂质的作用;
(2)温度越高,相同时间内FeO42-浓度变化越快,高铁酸钾溶液平衡时FeO42-浓度越小;温度越高FeO42-浓度越小,正向反应是吸热反应;
(3)根据图象的内容来分析图象所描述的意义;
(4)平衡常数等于生成物浓度幂之积与反应物浓度幂之积的比;
(5)根据溶度积常数计算.
(2)温度越高,相同时间内FeO42-浓度变化越快,高铁酸钾溶液平衡时FeO42-浓度越小;温度越高FeO42-浓度越小,正向反应是吸热反应;
(3)根据图象的内容来分析图象所描述的意义;
(4)平衡常数等于生成物浓度幂之积与反应物浓度幂之积的比;
(5)根据溶度积常数计算.
解答:解:(1)高铁酸钾(K2FeO4)具有极强的氧化性,是一种优良的水处理剂,起到杀菌消毒作用,形成胶体具有吸附悬浮杂质的作用;
故答案为:杀菌消毒、吸附悬浮物;
(2)由图1数据可知,温度越高,相同时间内FeO42-浓度变化越快,高铁酸钾溶液平衡时FeO42-浓度越小,温度越高FeO42-浓度越小,正向反应是吸热反应;
故答案为:>;
(3)A、不同PH值时,溶液中铁元素的存在形态及种数不相同,比如在PH值等于6时,就只有两种形态,故A错误;
B.根据图片知,改变溶液的pH,当溶液由pH=10降至pH=4的过程中,HFeO4-的分布分数先增大后减小,故正确;
C.向pH=8的这种溶液中加KOH溶液,发生反应的离子方程式为:HFeO4-+OH-=FeO42-+H2O,故错误;
D.根据图片知pH约为2.5 时,溶液中H3FeO4+和HFeO4-比例相当,故正确;
故选BD;
(4)HFeO4-?H++FeO42-的电离平衡常数表达式为K=
,根据图象知,等HFeO4-和FeO42-
浓度相等时,溶液中氢离子浓度接近中性,所以K接近10-7,
故答案为:
,C;
(5)25℃时,CaFeO4的Ksp=4.536×10-9,若要使100mL1.0×10-3mol?L-1的K2FeO4溶液中的c(FeO42- )完全沉淀,理论上至少要加入的Ca(OH)2的物质的量=
×0.1L=
mol/L×0.1L=4.536×10-5,[完全沉淀后溶液中残留的c(FeO42- )为 1×10-5mol/L,
故答案为:4.536×10-5,1×10-5mol/L.
故答案为:杀菌消毒、吸附悬浮物;
(2)由图1数据可知,温度越高,相同时间内FeO42-浓度变化越快,高铁酸钾溶液平衡时FeO42-浓度越小,温度越高FeO42-浓度越小,正向反应是吸热反应;
故答案为:>;
(3)A、不同PH值时,溶液中铁元素的存在形态及种数不相同,比如在PH值等于6时,就只有两种形态,故A错误;
B.根据图片知,改变溶液的pH,当溶液由pH=10降至pH=4的过程中,HFeO4-的分布分数先增大后减小,故正确;
C.向pH=8的这种溶液中加KOH溶液,发生反应的离子方程式为:HFeO4-+OH-=FeO42-+H2O,故错误;
D.根据图片知pH约为2.5 时,溶液中H3FeO4+和HFeO4-比例相当,故正确;
故选BD;
(4)HFeO4-?H++FeO42-的电离平衡常数表达式为K=
| c(H+).c(FeO42-) |
| c(HFeO4-) |
浓度相等时,溶液中氢离子浓度接近中性,所以K接近10-7,
故答案为:
| c(H+).c(FeO42-) |
| c(HFeO4-) |
(5)25℃时,CaFeO4的Ksp=4.536×10-9,若要使100mL1.0×10-3mol?L-1的K2FeO4溶液中的c(FeO42- )完全沉淀,理论上至少要加入的Ca(OH)2的物质的量=
| KSP |
| c(FeO42-) |
| 4.536×10-9 |
| 1.0×10-5 |
故答案为:4.536×10-5,1×10-5mol/L.
点评:本题考查了溶度积常数、电离平衡等知识点,难度中等,难点是溶度积常数的有关计算,当溶液中离子浓度为1×10-5mol/L时认为离子完全沉淀,为易错点.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 (FeSO4?7H2O)一起净水,其原理为
(FeSO4?7H2O)一起净水,其原理为 3Zn(OH)2+2Fe(OH)3+4KOH
3Zn(OH)2+2Fe(OH)3+4KOH 溶液的pH为
溶液的pH为