��Ŀ����
��8�֣�һ�������£������Ϊ3 L���ܱ������У�һ����̼��������Ӧ���ɼ״�������ΪCu2O/ZnO����CO(g)��2H2(g) CH3OH(g)��������������������⣺
CH3OH(g)��������������������⣺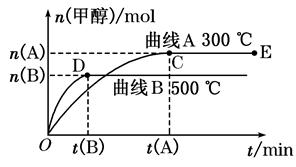
��1����Ӧ�ﵽƽ��ʱ��ƽ�ⳣ������ʽK��_________________�������¶ȣ�Kֵ___________�����������С�����䡱����ƽ���� �����ƶ���
��2����500�棬�ӷ�Ӧ��ʼ��ƽ�⣬������ƽ����Ӧ����v(H2)��________________��
��3���������������������£�������E�����ϵ���ѹ����ԭ����1/2�������йظ���ϵ��˵����ȷ����________��ѡ��ѡ����ĸ����
| A��������Ũ�ȼ��� |
| B������Ӧ���ʼӿ죬�淴Ӧ����Ҳ�ӿ� |
| C���״������ʵ������� |
D������ƽ��ʱ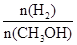 ���� ���� |
��1�� �� ��С �� �淴Ӧ �� ��2��
�� ��С �� �淴Ӧ �� ��2�� mol/(L��min) ��
mol/(L��min) ��
��3��BC �� ��4��Cu2O��CO 2Cu��CO2
2Cu��CO2
���������������1����ѧƽ�ⳣ������һ�������£������淴Ӧ�ﵽƽ��״̬ʱ��������Ũ�ȵ���֮���ͷ�Ӧ��Ũ�ȵ���֮���ı�ֵ�����Ը��ݷ�Ӧ�Ļ�ѧ����ʽ��֪���÷�Ӧ��ƽ�ⳣ��K�� ������ͼ���֪�������¶ȣ��״������ʵ�����С����˵��ƽ�������ƶ�����˻�ѧƽ�ⳣ����С��
������ͼ���֪�������¶ȣ��״������ʵ�����С����˵��ƽ�������ƶ�����˻�ѧƽ�ⳣ����С��
��2����ͼ���֪����500��ʱ��ʱ��ﵽt(B)ʱ���״������ʵ���Ϊn(B)����Ũ���� mol/L������ݷ���ʽ��֪���������������ʵ���Ũ����2��
mol/L������ݷ���ʽ��֪���������������ʵ���Ũ����2�� mol/L��������500�棬�ӷ�Ӧ��ʼ��ƽ�⣬������ƽ����Ӧ����v(H2)��
mol/L��������500�棬�ӷ�Ӧ��ʼ��ƽ�⣬������ƽ����Ӧ����v(H2)�� ��
�� mol?��L?min��-1��
mol?��L?min��-1��
��3��������������ʱ��������E�����ϵ���ѹ����ԭ���� �������������С����ѹǿ�������淴Ӧ���ʶ�����.��������Ӧ�������С�ģ�����ƽ���������ƶ����״������ʵ������࣬���������ʵ�����С�������������С��ƽ��ʱ������Ũ�ȷ������������ȷ��ѡBC��
�������������С����ѹǿ�������淴Ӧ���ʶ�����.��������Ӧ�������С�ģ�����ƽ���������ƶ����״������ʵ������࣬���������ʵ�����С�������������С��ƽ��ʱ������Ũ�ȷ������������ȷ��ѡBC��
��4������CO�ܺ�������ͭ��ӦCu2O+CO 2Cu+CO2�����Լ��������̼ƽ�����淴Ӧ�����ƶ������������Ʒ�Ӧ������Ӧ�����ƶ���ά��Cu2O�������䡣
2Cu+CO2�����Լ��������̼ƽ�����淴Ӧ�����ƶ������������Ʒ�Ӧ������Ӧ�����ƶ���ά��Cu2O�������䡣
���㣺����ƽ�ⳣ�������������ƽ��״̬��Ӱ���Լ���Ӧ���ʵļ����

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д���16�֣���ҵ�Ͽ����ں����ܱ������в������з�Ӧ�Ʊ��״���
CO��g����2H2��g�� CH3OH��g��
CH3OH��g��
��1���������������Ϊ�жϷ�Ӧ�ﵽƽ��״̬�����ݵ��ǣ�����ţ� ��
A������CH3OH ������������H2������֮��Ϊ1�U2
B����������ƽ����Է����������ֲ���
C�����������ܶȱ��ֲ���
D����ϵ�ڵ�ѹǿ���ֲ���
��2���±���������Ϊ�÷�Ӧ�ڲ�ͬ�¶��µĻ�ѧƽ�ⳣ����
| �¶�/�� | 250 | 300 | 350 |
| K | 2.041 | 0.270 | 0.012 |
�ٷ�Ӧ��ƽ�ⳣ������ʽΪK= �����ϱ������жϣ��÷�Ӧ�ġ�H 0����������������������������¶ȣ�����Ӧ���� �����������С�����䡱����
��ij�¶��£���2molCO��6molH2����һ���ݻ�Ϊ2L���ܱ������У��ﵽƽ��ʱc(H2)=1.4mol/L����CO��ת����Ϊ ����ʱ���¶�Ϊ ��
��3�������CO��ת���ʣ��ɲ�ȡ�Ĵ�ʩ�� ��������ţ�
A������
B���������Ч�Ĵ���
C�����������³���CO
D�����������³���H��
E�����������³��뺤��
F����ʱ����CH3OH
��4��һ�������£�CO��H2�ڴ�������������1molCH3OH�������仯Ϊ90.8kJ�����¶��£��������ݻ���ͬ���ܱ������У�����ͬ��ʽͶ�ϣ����ֺ��¡����ݣ���÷�Ӧ�ﵽƽ��ʱ���й��������£�
| ���� | �� | �� | �� | |
| Ͷ�Ϸ�ʽ | 1molCO��2molH2 | 1molCH3OH | 2molCH3OH | |
| ƽ������ | C(CH3OH)/(mol/L) | c1 | c2 | c3 |
| ��ϵѹǿ(Pa) | p1 | p2 | p3 | |
| ��Ӧ�������仯 | akJ | bkJ | ckJ | |
| ԭ��ת���� | ��1 | ��2 | ��3 | |
���з�����ȷ���� ��������ţ�
A��2c1��c3 B��2 p1��p3 C��|a|��|b|��90.8 D����1����3��1
I���跴Ӧ��Fe(s)+CO2(g) FeO(s)+CO(g)��ƽ�ⳣ��ΪK1����Ӧ ��Fe(s)+H2O(g)
FeO(s)+CO(g)��ƽ�ⳣ��ΪK1����Ӧ ��Fe(s)+H2O(g)  FeO(s)+H2(g)��ƽ�ⳣ��ΪK2���ڲ�ͬ�¶��£�K1��K2��ֵ���£�
FeO(s)+H2(g)��ƽ�ⳣ��ΪK2���ڲ�ͬ�¶��£�K1��K2��ֵ���£�
| T(K) | K1 | K2 |
| 973 | 1.47 | 2.36 |
| 1173 | 2.15 | 1.67 |
��1�����з�Ӧ��CO2(g)+H2(g)
 CO(g)+H2O(g)������һ�� (������š�)�ȷ�Ӧ��Ҫʹƽ��������ƶ����ɲ�ȡ�Ĵ�ʩ�� (�����)��
CO(g)+H2O(g)������һ�� (������š�)�ȷ�Ӧ��Ҫʹƽ��������ƶ����ɲ�ȡ�Ĵ�ʩ�� (�����)��A����С��Ӧ�����ݻ�
B������Ӧ�����ݻ�
C�������¶�
D�������¶�
E��ʹ�ú��ʵĴ���
F���跨����CO����
��2������ӦFe(s)+CO2(g)
 FeO(s)+CO(g)���¶�T1�½��У�Fe(s)+H2O(g)
FeO(s)+CO(g)���¶�T1�½��У�Fe(s)+H2O(g)  FeO(s)+H2(g)���¶�T2�½��У���֪T1��T2����c(CO2)��c(H2O)(������������ͬ)�������ߵķ�Ӧ���� (�����)��
FeO(s)+H2(g)���¶�T2�½��У���֪T1��T2����c(CO2)��c(H2O)(������������ͬ)�������ߵķ�Ӧ���� (�����)��A��ǰ�ߴ� B�����ߴ� C��һ���� D�����ж�
II����1�������ı��淢�������ڴ����dz��õķ�������������ƽ��Ҫ��Ӧ�ķ���ʽ��
��Na2FeO2+��NaNO2+��H2O=��NaFeO2+��NH3��+��NaOH
��2���������䡢ŨHNO3�����ۻ����ܴﵽ����Ŀ�ģ���ͬŨ�ȵ�HNO3������Ӧ�Ļ�ԭ����ܸ��ӣ���ֲ�������ͼ��

��ͼʾ��֪������HNO3������Ӧ�Ĺ����� ��
�ڹ�ҵ��һ�㲻����Ũ������������洦��������ܵ�ԭ���� ��
��3������(M)�ĸ�ʴ����Ϊ������Ӧ��M-ne-��Mn+�������������洦���ķ����⣬���з���Ҳ���������õ��� (����ĸ���)
A�������в�����Ƚ����Ƴɲ����
B��������Ʒ�����п
C��������к�̼�����Ƴ�����
D����ˮ����բ����ֱ����Դ�ĸ�������
 2CO(g)����H��0
2CO(g)����H��0
 2SO3����д���пհף�
2SO3����д���пհף�
 H2S(g) ��H=��21��6kJ��mol��1����Ӧ�ﵽƽ��ʱH2��S��H2S�����ʵ�����Ϊ3 mol����380 Kʱ�÷�Ӧ�Ļ�ѧƽ�ⳣ��Ϊ______�����жԸ÷�Ӧ������ȷ����______(����ĸ���)��
H2S(g) ��H=��21��6kJ��mol��1����Ӧ�ﵽƽ��ʱH2��S��H2S�����ʵ�����Ϊ3 mol����380 Kʱ�÷�Ӧ�Ļ�ѧƽ�ⳣ��Ϊ______�����жԸ÷�Ӧ������ȷ����______(����ĸ���)��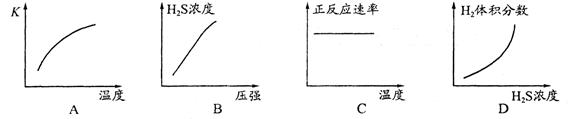
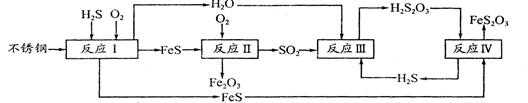
 2Cl2+2H2O����ʵ���ȵ�ѭ�����á�
2Cl2+2H2O����ʵ���ȵ�ѭ�����á�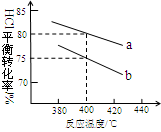
 3C(g) �� D(s)����Ӧ�ﵽƽ��ʱC��Ũ��Ϊ1.2 mol/L.
3C(g) �� D(s)����Ӧ�ﵽƽ��ʱC��Ũ��Ϊ1.2 mol/L.