题目内容
在真空密闭装置中,亚氯酸钠(NaClO2)固体在一定条件下发生分解反应,不可能形成的产物是
| A.NaCl和O2 | B.NaClO3和NaClO | C.NaClO3和Cl2 | D.NaClO3和NaCl |
C
解析试题分析:NaClO2中元素的化合价为+3价,当发生分解反应时,如自身发生氧化还原反应,化合价既升高又降低,可生成NaClO3和NaClO或NaClO3和NaCl,NaClO2中Na和Cl物质的量之比为1:1,生成时NaClO3,另一种生成物种应含有Na和Cl,否则不能遵循质量守恒定律,即不可能生成Cl2,如Cl和O之间发生氧化还原反应,则O元素化合价升高,Cl元素化合价降低,可生成NaCl和O2,故选C.
考点:本题考查氧化还原反应,题目难度不大,注意把握亚氯酸钠分解的性质,易错点为C,注意从质量守恒的角度分析.

练习册系列答案
相关题目
水热法制备Fe3O4纳米颗粒的反应是3Fe2++2S2O32-+O2+xOH—=Fe3O4+S4O62-+2H2O,下列说法中,正确的是
| A.Fe2+和S2O32—都是还原剂 |
| B.x=6 |
| C.1mol Fe2+被氧化时,被Fe2+还原的O2的物质的量为1/3mol |
| D.每生成1mol Fe3O4,反应转移的电子总数为3mol |
我国的新(饮用天然矿泉水国家标准)规定了饮用水中可能致癌物溴酸盐的限值:0.01mg/L,日前很多饮用水企业都采用臭氧消毒法进行水的消毒,这个过程可能生成溴酸盐。原因是水中的Br-被臭氧氧化为BrO2-,其过程示意为:Br-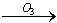 BrO-
BrO-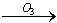 BrO2-
BrO2-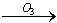 BrO3-,下列有关说法正确的是
BrO3-,下列有关说法正确的是
| A.臭氧消毒法和明矾净水原理相同,都是利用胶体吸附原理 |
| B.若改用氧气消毒,可避免生成溴酸盐 |
| C.BrO- 3氧化性比O3强 |
| D.生成溴酸盐的过程是给水消毒的副反应,需控制条件减少BrO3-的产生 |
工业上可用硫酸铝与硫磺焙烧制备氧化铝:2A12(SO4)2+3S 2Al2O3+9SO2↑,下列有关说法中正确的是( )
2Al2O3+9SO2↑,下列有关说法中正确的是( )
| A.反应中Al2(SO4)3被氧化 |
| B.Al2(SO4)3、A12O3均含有离子键和共价键 |
| C.5.1 g A12O3含有9.03×1022个阴离子 |
| D.该反应中,每转移0.3 mol电子生成5.04 L SO2 |
下列工业生产的主要反应原理不涉及氧化还原反应的是
| A.硝酸工业 | B.接触法制硫酸 | C.合成氨工业 | D.氨碱法制纯碱 |
下列物质性质的比较,正确的是
| A.热稳定性:Na2CO3>NaHCO3>H2CO3 |
| B.熔点:K>Na>Li |
| C.同条件下,同浓度溶液的pH值:NaHCO3>Na2CO3 |
| D.还原性:S2->Br->I- |
下列陈述I、II正确并且有因果关系的是
| 选项 | 陈述I | 陈述II |
| A | H2O2、SO2都能使酸性高锰酸钾褪色 | 前者表现出还原性后者表现出漂白性 |
| B | 纯银器表面在空气中渐渐变暗 | 发生了化学腐蚀 |
| C | SiO2能与氢氟酸及碱反应 | SiO2是两性氧化物 |
| D | BaSO4饱和溶液中加入饱和Na2CO3溶液有白色沉淀 | 说明Ksp(BaSO4)大于Ksp(BaCO3) |