题目内容
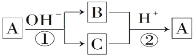
【题目】下图为某漂白剂的结构。已知:W、Y、Z是不同周期、不同主族的短周期元素,W、Y、Z原子最外层电子数之和等于X原子最外层电子数,W、X对应的简单离子核外电子排布相同。下列叙述错误的是
![]()
A.W、X对应的简单离子的半径:X>W
B.Y元素在周期表中的位置为二周期第IVA族
C.将W的氯化物的水溶液加热蒸干并灼烧可得到W的氧化物
D.该漂白剂结构中,Y、X原子的最外层均满足8电子结构。
【答案】B
【解析】
W、Y、Z是不同周期、不同主族的短周期元素,说明有一种元素为H元素,根据图示结构可知,W形成+2价阳离子,X形成2个共价键,Y可以形成4个单键,Z形成1个共价键,则Z为H原子,W位于ⅡA族,X是ⅥA族元素,W、X对应的简单离子核外电子排布相同,则W是Mg元素,X是O元素,W、Y、Z原子最外层电子数之和等于X原子最外层电子数,Y的最外层电子数为6-2-1=3,Y与H、Mg不同周期,则Y为B元素,据此分析。
A.由于W、X对应的简单离子核外电子排布相同,则核电荷数大的离子半径小,故W、X对应的简单离子的半径:X>W,A项正确;
B.Y为B元素,位于元素周期表中第二周期第ⅢA族,B项错误;
C.W的氯化物的水溶液为MgCl2溶液,Mg2+在溶液中会水解生成Mg(OH)2,而生成的HCl为挥发性酸。MgCl2溶液蒸干灼烧后,可得到MgO,C项正确;
D.该漂白剂中,B、O原子最外层均满足8电子结构,D项正确;
答案选B。

 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案 小题狂做系列答案
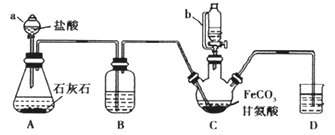
小题狂做系列答案【题目】甘氨酸亚铁[(NH2CH2COO)2Fe]是一种补铁强化剂。某学习小组利用FeCO3与甘氨酸(NH2CH2COOH)制备甘氨酸亚铁,实验装置如下图所示(夹持和加热仪器已省略)。
有关物质性质如下表
甘氨酸 | 柠檬酸 | 甘氨酸亚铁 |
易溶于水,微溶于乙醇 | 易溶于水和乙醇 | 易溶于水,难溶于乙醇 |
两性化合物 | 强酸性、强还原性 |
实验过程:
Ⅰ合成:装置C中盛有0.2 mol FeCO3和200 mL 1.0 mol·L1甘氨酸溶液和适量柠檬酸。实验时,先打开仪器a的活塞,待装置C中空气排净后,加热并不断搅拌,并通过仪器b向C中加入适量氢氧化钠溶液调节pH到6左右,使反应物充分反应。
Ⅱ分离:反应结束后,过滤,将滤液进行蒸发浓缩;加入无水乙醇,过滤、洗涤并干燥。
回答下列问题:
(1)仪器C的名称是___________;与a相比,仪器b的优点是_______。
(2)装置B盛装的试剂为_____________。
(3)合成过程加入柠檬酸的作用是促进FeCO3溶解和______________。
(4)加入氢氧化钠溶液调节pH若大于6,甘氨酸亚铁产量下降。原因可用离子方程式表示为________________。
(5)过程II中洗涤操作为________。
(6)检验产品中是否含有Fe3+的最佳试剂是_________(写化学用语)。
(7)本实验制得15.3 g 甘氨酸亚铁(M=204g/mol),则其产率是_______%。