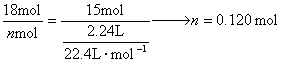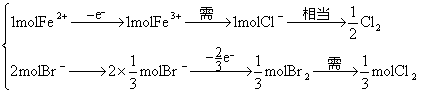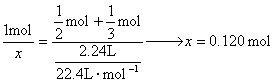题目内容
在100 mL的![]() 溶液中,通入2.24 L标准状况下的氯气,充分反应后,溶液中有
溶液中,通入2.24 L标准状况下的氯气,充分反应后,溶液中有![]() 的
的![]() 被氧化成溴单质.求原
被氧化成溴单质.求原![]() 溶液的物质的量浓度.
溶液的物质的量浓度.
答案:
解析:
提示:
解析:
方法(一)方程式法: 题中给出通入标况下2.24 L氯气后, 由Br、Fe、Cl分别守恒得到 代入方程化为整数: c( 方法(二): 因 1 mol 则原溶液中 c( 方法(三)电子守恒法: 设溶液中 x=1.20 mol·
|
提示:
解某些计算题时,能用守恒法尽可能用守恒法,如上述三种方法包括了:元素守恒、物质的量守恒,电子得失守恒,还有电荷守恒、浓度守恒、体积守恒、溶质守恒、质量守恒等的存在,在化学计算中守恒法运用十分广泛,特别是有关混合物的计算或是反应关系复杂的化学试题,运用守恒法求解,使解题过程简化,解题效率提高
|

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
|
在100 mL的溶液中溶有0.1 mol NaCl和0.1 mol MgCl2,此溶液中Cl-的物质的量浓度为 | |
| [ ] | |
A. |
3 mol/L |
B. |
2 mol/L |
C. |
0.3 mol/L |
D. |
0.2 mol/L |
|
在100 mL的溶液中有0.1 mol NaCl和0.1 mol MgCl2,此溶液中Cl-的物质的量浓度为 | |
| [ ] | |
A. |
0.3 mol·L-1 |
B. |
2 mol·L-1 |
C. |
3 mol·L-1 |
D. |
0.2 mol·L-1 |