题目内容
16.下列物质的变化过程中,需克服分子间作用力的是( )| A. | 碘化氢的分解 | B. | 生石灰的熔化 | C. | 氯化钠的熔化 | D. | 酒精的蒸发 |
分析 先判断断键方式,再判断克服的作用力,只需克服分子间作用力,则晶体为分子晶体,且未发生化学键断裂.
解答 解:A、碘化氢是分子晶体,碘化氢受热分解为氢气和碘,破坏是氢、碘间的共价键,故A错误;
B、生石灰是离子晶体,微粒间的作用力是离子键,生石灰的熔化破坏了离子键,故B错误;
C、氯化钠是离子晶体,微粒间的作用力是离子键,氯化钠的熔化破坏了离子键,故C错误;
D、酒精是分子晶体,受热蒸发,克服的是分子间作用力,故D正确.
故选D.
点评 本题考查物质的成键方式,此类题的解题方法是:先判断断键方式,再判断克服的作用力.

练习册系列答案
相关题目
2.下列有关实验装置或实验操作正确的是( )
| A. | 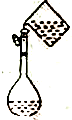 配置一定物质的量浓度的溶液 | B. | 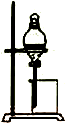 用CCl2萃取碘水中的溴 | ||
| C. | 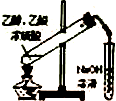 制备乙酸乙酯 | D. | 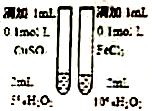 比较不同催化剂对反应速率的影响 |
7.已知:相关物质的溶度积常数见表:
现有某酸性CuCl2溶液中含有少量的FeCl2,为得到纯净的CuCl2•2H2O晶体,按如图步骤进行提纯:

(1)最适合作氧化剂X的是C(填字母),加入X的目的是将Fe2+氧化成Fe3+,便于生成沉淀与Cu2+分离.
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
加入的物质Y是CuO、Cu(OH)2、CuCO3、Cu2(OH)2CO3(填化学式),调至溶液pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=2.6×10-9mol/L.过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2•2H2O晶体.
(2)某学习小组用“间接碘量法”测定含有CuCl2•2H2O晶体的试样(不含能与I-发生反
应的氧化性杂质)的纯度,过程如下:取0.36g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀.用0.1000mol•L-1Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00mL.(I2+2S2O32-═S4O62-+2I-)
①可选用淀粉溶液作滴定指示剂.②CuCl2溶液与KI反应的离子方程式为2Cu2++4I-=2CuI↓+I2.
③该试样中CuCl2•2H2O的质量百分数为95%.
| 物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |

(1)最适合作氧化剂X的是C(填字母),加入X的目的是将Fe2+氧化成Fe3+,便于生成沉淀与Cu2+分离.
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
加入的物质Y是CuO、Cu(OH)2、CuCO3、Cu2(OH)2CO3(填化学式),调至溶液pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=2.6×10-9mol/L.过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2•2H2O晶体.
(2)某学习小组用“间接碘量法”测定含有CuCl2•2H2O晶体的试样(不含能与I-发生反
应的氧化性杂质)的纯度,过程如下:取0.36g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀.用0.1000mol•L-1Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00mL.(I2+2S2O32-═S4O62-+2I-)
①可选用淀粉溶液作滴定指示剂.②CuCl2溶液与KI反应的离子方程式为2Cu2++4I-=2CuI↓+I2.
③该试样中CuCl2•2H2O的质量百分数为95%.
11.从原子序数11依次增加到17,下列叙述中正确的是( )
| A. | 电子层数逐渐增多 | B. | 原子半径逐渐增大 | ||
| C. | 最高正化合价数值逐渐增大 | D. | 从硅到氯负价从-1→-4 |
1.用括号内的试剂除去下列各物质中少量的杂质,正确的是( )
| A. | 溴苯中的溴(碘化钾溶液) | B. | 乙烷中的乙烯(氢气) | ||
| C. | 乙酸乙酯中的乙酸(饱和碳酸钠溶液) | D. | 苯中的甲苯(溴水) |
8.当光束通过下列分散系时,能产生丁达尔效应的是( )
| A. | NaCl溶液 | B. | Fe(OH)3胶体 | C. | 浓硫酸 | D. | 泥浆 |
5.生活中很多现象都涉及能量的转化.下列反应中属于吸热反应是( )
| A. | 煅烧石灰石 | B. | 炸药爆炸 | ||
| C. | 食物因氧化而腐败 | D. | 石灰水中和酸性土壤 |
6.科研人员设想用如图所示装置生产硫酸,下列说法正确的是( )
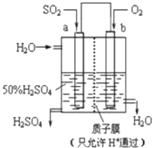

| A. | a为正极,b为负极 | |
| B. | 生产过程中H+向a电极区域运动 | |
| C. | 电子从b极向a极移动 | |
| D. | 负极反应式为:2H2+SO2-2e-=SO42-+4H+ |
 已知甲、乙、丙、X是4种中学化学中常见的物质,其转化关系符合如图.则甲和X是
已知甲、乙、丙、X是4种中学化学中常见的物质,其转化关系符合如图.则甲和X是