题目内容
在容积固定为2L的密闭容器中,充入0.180molHI,480℃时反应:2HI(g)?H2(g)+I2(g),体系中n(HI)随时间变化情况如表:
反应进行至10min后将反应混合物的温度降低,发现气体的颜色变浅.
(1)0~2min内H2的平均反应速度为 .达平衡时,HI的转化率是 .
(2)上述正向反应是: 反应(选填:放热、吸热).
(3)某温度下上述反应平衡时,恒容、升高温度,原化学平衡向 反应方向移动(填“正”或“逆”),正反应速率 (填“增大”、“减小”或“不变”),容器内混合气体的压强 (填“增大”、“减小”或“不变”).
(4)480℃时,反应H2(g)+I2(g)?2HI(g)的平衡常数K的值为 .
(5)要增大反应2HI(g)?H2(g)+I2(g)的平衡常数,可采取的措施是 (选填字母).
A.增大HI起始浓度
B.向混合气体中通入I2
C.使用高效催化剂
D.升高温度.
| t/min | 0 | 2 | 4 | 6 | 8 | 10 |
| n(HI)/mol | 0.180 | 0.164 | 0.152 | 0.144 | 0.140 | 0.140 |
(1)0~2min内H2的平均反应速度为
(2)上述正向反应是:
(3)某温度下上述反应平衡时,恒容、升高温度,原化学平衡向
(4)480℃时,反应H2(g)+I2(g)?2HI(g)的平衡常数K的值为
(5)要增大反应2HI(g)?H2(g)+I2(g)的平衡常数,可采取的措施是
A.增大HI起始浓度
B.向混合气体中通入I2
C.使用高效催化剂
D.升高温度.
考点:化学平衡的计算,化学平衡的影响因素
专题:化学平衡专题
分析:(1)根据反应速率的表达计算出0~2min内氢气的平均反应速率;
(2)反应进行至10min后将反应混合物的温度降低(I2仍为气态),发现气体的颜色变浅,说明平衡向着逆向移动,正反应为吸热反应;
(3)升高温度,平衡向着正向移动;正逆反应速率都会增大;温度升高,压强增大;
(4)根据化学平衡常数表达式计算出反应H2(g)+I2(g)?2HI(g)的平衡常数K;
(5)平衡常数与温度有关,改变浓度、使用催化剂不影响平衡常数.
(2)反应进行至10min后将反应混合物的温度降低(I2仍为气态),发现气体的颜色变浅,说明平衡向着逆向移动,正反应为吸热反应;
(3)升高温度,平衡向着正向移动;正逆反应速率都会增大;温度升高,压强增大;
(4)根据化学平衡常数表达式计算出反应H2(g)+I2(g)?2HI(g)的平衡常数K;
(5)平衡常数与温度有关,改变浓度、使用催化剂不影响平衡常数.
解答:
解:(1)HI的物质的量变化为:0.180mol-0.164mol=0.016nol,根据反应:2HI(g)?H2(g)+I2(g),生成氢气的物质的量为0.008mol,
0~2min内氢气的平均反应速率为:
=0.002mol/(L?min),达到平衡时,HI的浓度为0.140mol/L,转化的浓度为0.180mol/L-0.140mol/L=0.040mol/L,HI的转化率为
×100%=22.2%,
故答案为:0.002mol/(L?min);22.2%;
(2)由于反应进行至10min后将反应混合物的温度降低(I2仍为气态),发现气体的颜色变浅,说明平衡向着逆向移动,正反应为吸热反应,故答案为:吸热;
(3)升高温度,平衡向着吸热方向移动,即向着正向移动,升高温度,气体压强增大,正逆反应速率都会增大,故答案为:正;增大;增大;
(4)达到平衡状态时,n(HI)=0.140mol,n(H2)=n(I2)=0.5×(0.18mol-0.14mol)=0.02mol,
所以c(HI)=0.07mol/L,c(I2)=c(H2)=0.01mol/L,
480℃时,反应H2(g)+I2(g)?2HI(g)的平衡常数K=
=
=49,
故答案为:49;
(5)反应进行至10min后将反应混合物的温度降低,说明该反应为吸热反应,根据影响平衡常数的因素可知,平衡常数只与温度有关,所以要增大平衡常数,只能改变温度,故答案为:D.
0~2min内氢气的平均反应速率为:
| ||
| 2min |
| 0.040mol/L |
| 1.80mol/L |
故答案为:0.002mol/(L?min);22.2%;
(2)由于反应进行至10min后将反应混合物的温度降低(I2仍为气态),发现气体的颜色变浅,说明平衡向着逆向移动,正反应为吸热反应,故答案为:吸热;
(3)升高温度,平衡向着吸热方向移动,即向着正向移动,升高温度,气体压强增大,正逆反应速率都会增大,故答案为:正;增大;增大;
(4)达到平衡状态时,n(HI)=0.140mol,n(H2)=n(I2)=0.5×(0.18mol-0.14mol)=0.02mol,
所以c(HI)=0.07mol/L,c(I2)=c(H2)=0.01mol/L,
480℃时,反应H2(g)+I2(g)?2HI(g)的平衡常数K=
| c2(HI) |
| c(H2)c(I2) |
| 0.072 |
| 0.01×0.01 |
故答案为:49;
(5)反应进行至10min后将反应混合物的温度降低,说明该反应为吸热反应,根据影响平衡常数的因素可知,平衡常数只与温度有关,所以要增大平衡常数,只能改变温度,故答案为:D.
点评:本题考查了化学平衡的建立过程,涉及的知识点较多,注意平衡常数与温度有关,与浓度、催化剂无关,本题难度中等.

练习册系列答案
相关题目
安全教育是化学教育的重要内容.根据你掌握的知识判断,下列各项中符合安全操作要求的是( )
①在加油站内拨打手机
②在煤矿巷道内用明火照明
③闻氯气的气味时,用手轻轻在瓶口扇动,仅使极少量的氯气飘进鼻孔
④为了节约药品,锌与稀硫酸一开始反应,就做氢气点燃实验
⑤稀释浓硫酸时,沿烧杯内壁将浓硫酸缓缓加入水中,边加边搅拌
⑥不慎将酒精灯打翻在桌上失火时,立即用湿抹布盖灭
⑦不慎将酸液溅到眼中,应立即用水冲洗,边洗边眨眼睛
⑧不慎将浓碱溶液沾到皮肤上,要立即用大量水冲洗,然后涂上硼酸溶液.
①在加油站内拨打手机
②在煤矿巷道内用明火照明
③闻氯气的气味时,用手轻轻在瓶口扇动,仅使极少量的氯气飘进鼻孔
④为了节约药品,锌与稀硫酸一开始反应,就做氢气点燃实验
⑤稀释浓硫酸时,沿烧杯内壁将浓硫酸缓缓加入水中,边加边搅拌
⑥不慎将酒精灯打翻在桌上失火时,立即用湿抹布盖灭
⑦不慎将酸液溅到眼中,应立即用水冲洗,边洗边眨眼睛
⑧不慎将浓碱溶液沾到皮肤上,要立即用大量水冲洗,然后涂上硼酸溶液.
| A、③⑤⑥⑦⑧ | B、①②④ |
| C、①②⑥⑦⑧ | D、③④⑤⑦⑧ |
下列各组物质既不是同系物又不是同分异构体的是( )
| A、软脂酸和硬脂酸 |
| B、甲酸甲酯和乙酸 |
| C、油酸和乙酸 |
| D、对甲基苯酚和苯甲醇 |
A、B、C、D 4种化合物,其焰色反应均为浅紫色,A、B、C和盐酸反应都可得到D;B、C 以等物质的量在溶液中反应可得到A;若在B溶液中通入一种无色无刺激性气味的气体,适量时得A,过量时得C,则A、B、C、D分别是( )
| A、KHCO3 KAlO2 K2CO3 KCl |
| B、K2CO3 KOH KHCO3 KCl |
| C、K2SO4 KOH KHSO4 KCl |
| D、K2CO3 K2SiO3 KOH KCl |
使石蕊试液变红的某透明溶液中,下列各组离子能大量共存的是( )
| A、CO32-、Na+、K+、OH- |
| B、Ba2+、CO32-、NO3-、SO42- |
| C、K+、Cu2+、Cl-、SO42- |
| D、Fe2+、NO3-、Cl-、SO42- |
在强酸性溶液中,可以大量共存的离子组是( )
| A、Na+、K+、CH3COO-、Cl- |
| B、Ba2+、Na+、CO32-、NO3- |
| C、Na+、Ag+、SO42-、Cl- |
| D、Al3+、Fe3+、NO3-、SO42- |
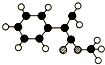 A是生产某新型工程塑料的基础原料之一,分子式为C10H10O2,其分子结构模型如图所示(如图中球与球之间连线代表化学键单键或双键).
A是生产某新型工程塑料的基础原料之一,分子式为C10H10O2,其分子结构模型如图所示(如图中球与球之间连线代表化学键单键或双键). 目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为1L的客闭容器中,充入1molCO2和3molH2,在500℃下发生反应:CO2(g)+3H2O(g)?CH3OH(g)+H2O(g);
目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为1L的客闭容器中,充入1molCO2和3molH2,在500℃下发生反应:CO2(g)+3H2O(g)?CH3OH(g)+H2O(g);