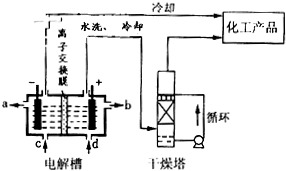
题目内容
|
将Mg、Al、Si的混合物分为等质量的两份,一份跟足量的NaOH溶液反应,另一份与足量的盐酸反应,最终产生的H2一样多,则Mg与Si的物质的量之比为 | |
A. |
2∶1 |
B. |
4∶1 |
C. |
1∶1 |
D. |
3∶1 |
答案:C
提示:
提示:
|
同质量的Al与酸、碱反应放出的H2一样多,则Mg与盐酸和Si与碱反应放出的H2一样多. |

练习册系列答案
相关题目
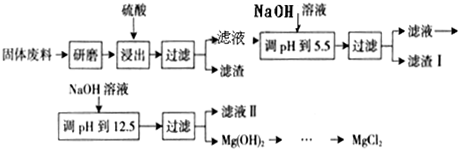
工业上需要利用一批回收的含铜废料制造胆矾(CuSO4?5H2O).该废料中各种成份含量如下:Cu和CuO约占87%,其它为Mg、Al、Fe、Si及其氧化物,还有少量的难溶物质.工艺流程为:
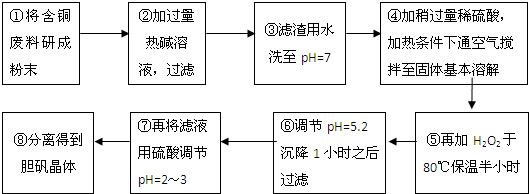
部分金属阳离子以氢氧化物形式完全沉淀时溶液的pH如下表:
回答:
(1)步骤①中为什么要将含铜废料研磨成粉状?
(2)步骤②中的离子方程式(写出2个即可): 、 .
步骤⑤中H2O2参加反应的离子方程式:
(3)步骤⑥中调节溶液pH时适宜的物质是 (填序号);
A.NaOH B.氨水 C.Cu2(OH)2CO3 D.Cu(OH)2 E.MgCO3
步骤⑥中滤渣主要成份的化学式
(4)步骤⑦中用硫酸调节pH=2~3的原因是
步骤⑧的分离方法是 .

部分金属阳离子以氢氧化物形式完全沉淀时溶液的pH如下表:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Cu(OH)2 | Mg(OH)2 | Fe(OH)2 |
| pH | 5.2 | 3.1 | 6.7 | 9.4 | 9.7 |
(1)步骤①中为什么要将含铜废料研磨成粉状?
(2)步骤②中的离子方程式(写出2个即可):
步骤⑤中H2O2参加反应的离子方程式:
(3)步骤⑥中调节溶液pH时适宜的物质是
A.NaOH B.氨水 C.Cu2(OH)2CO3 D.Cu(OH)2 E.MgCO3
步骤⑥中滤渣主要成份的化学式
(4)步骤⑦中用硫酸调节pH=2~3的原因是
步骤⑧的分离方法是
将10.6 g由Mg、Al、Si组成的合金投入足量的NaOH溶液中,在标准状况下产生气体11.2L;另取等质量的合金溶于过量稀H2SO4中,合金质量减少了7.8g。则合金中Mg、Al、Si的物质的量之比为( )
| A.1:2:1 | B.2:1:1 | C.1:3:2 | D.1:1:2 |