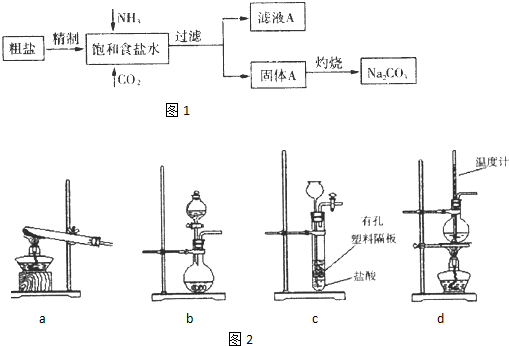
题目内容
一定量CO2通入某浓度的NaOH溶液得溶液A,向A溶液中逐滴滴入稀盐酸,加入n(HCl)与生成n(CO2)的关系如图所示.下列有关叙述正确的是

A.通入的CO2气体为22.4 L
B.A溶液中n(NaOH)=2n(Na2CO3)
C.A溶液中既含Na2CO3,又含NaHCO3
D.A溶液中一定只有Na2CO3
【答案】
B
【解析】
试题分析:A项:完全反应后, 生成的nCO2= 1mol, 标准状况下=22.4L, 不可能大于. A不对;B项:显然, 开始时所用的CO2为1mol, ,NaHCO3 + HCl = NaCl + H2O + CO2↑,此反应消耗HCl 1mol (从nHCl = 3到nHCl = 4 mol),之前消耗HCl 3mol,即使CO2与NaOH反应全部生成Na2CO3:Na2CO3 + HCl = NaCl + NaHCO3,此反应仅消耗HCl 1mol, 剩下的2mol HCl与NaOH反应. 所以,溶液A中有NaOH, 不可能有NaHCO3。HCl + NaOH = NaCl + H2O,即溶液A中有2mol NaOH, 1mol Na2CO3, B正确;C项:参见B, C不对;D项:C不对, 有NaOH和Na2CO3。故选B。
考点:钠的化合物的性质 化学计算

练习册系列答案
 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案
相关题目
某化学活动小组探究SO2、CO2对品红溶液是否都有漂白作用.
【实验原理】
利用碳酸盐和亚硫酸盐分别与酸反应可以生成CO2和SO2,然后让两种气体直接与品红溶液作用.
【实验装置】
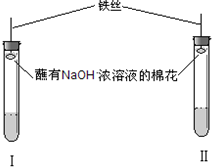
【实验操作和现象】
①请你判断两种气体对品红的漂白性,并将你的结论填写在上表中.
②该实验装置中胶塞上都附着蘸有浓NaOH溶液的棉花,其作用是: .
【问题探究】
他们推测品红可能是一种酸碱指示剂
①你认为他们推测的依据是 .
②请你帮助他们设计实验验证上述推测.实验方案: .
【问题延伸】
某同学将SO2通入酸性高锰酸钾溶液,溶液紫色褪去.他认为该现象表现出SO2的漂白性,你认为正确吗?若不正确,请回答原因;若正确,此空不答 .
【实验原理】
利用碳酸盐和亚硫酸盐分别与酸反应可以生成CO2和SO2,然后让两种气体直接与品红溶液作用.
【实验装置】

【实验操作和现象】
| 实验操作 | 实验现象 | 探究结论 |
| A.取少量品红溶液加入试管Ⅰ中,加入适量碳酸钠溶液,充分混合后再加入一定量的稀硫酸,并立即塞上塞子 | 溶液的红色逐渐褪去,加稀硫酸后溶液逐渐变红色 | CO2 |
| B.取少量品红溶液加入试管Ⅱ中,加入适量亚硫酸钠溶液,充分混合后再加入一定量的稀硫酸,并立即塞上塞子 | 溶液的红色逐渐褪去,加稀硫酸后溶液逐渐变红,随着反应的进行,颜色又逐渐消失 | SO2 |
②该实验装置中胶塞上都附着蘸有浓NaOH溶液的棉花,其作用是:
【问题探究】
他们推测品红可能是一种酸碱指示剂
①你认为他们推测的依据是
②请你帮助他们设计实验验证上述推测.实验方案:
【问题延伸】
某同学将SO2通入酸性高锰酸钾溶液,溶液紫色褪去.他认为该现象表现出SO2的漂白性,你认为正确吗?若不正确,请回答原因;若正确,此空不答