题目内容
对于反应2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O,若有0.1mol KMnO4参加反应,下列说法正确的是( )
| A、其转移电子0.5 mol |
| B、生成Cl2 0.5 mol |
| C、参加反应的HCl为16 mol |
| D、Cl2是还原产物 |
考点:氧化还原反应
专题:氧化还原反应专题
分析:该反应中Mn元素化合价由+7价变为+2价,氯元素的化合价由-1价变为0价,根据转移电子相等、原子守恒配平方程式得2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O,根据高锰酸钾和这些物理量之间的关系式计算.
解答:
解:A.转移电子的物质的量为0.1mol×(7-2)=0.5mol,故A正确;
B.根据反应方程式知,若有0.1molKMnO4 参加反应,应有0.25mol氯气生成,故B错误;
C.由方程式可知,若有0.1molKMnO4 参加反应,应有0.8molHCl参加反应,故C错误;
D.Cl元素化合价升高,Cl2为氧化产物,故D错误.
故选A.
B.根据反应方程式知,若有0.1molKMnO4 参加反应,应有0.25mol氯气生成,故B错误;
C.由方程式可知,若有0.1molKMnO4 参加反应,应有0.8molHCl参加反应,故C错误;
D.Cl元素化合价升高,Cl2为氧化产物,故D错误.
故选A.
点评:本题考查了氧化还原反应,为高频考点,侧重于学生的分析能力和计算能力的考查,明确元素化合价是解本题关键,注意该反应中参加反应的氯化氢部分被氧化,为易错点.

练习册系列答案
相关题目
下列叙述中正确的是( )
| A、CO2分子内含有极性键,所以CO2分子是极性分子 |
| B、气态氢化物的稳定性:NH3>PH3>AsH3 |
| C、分子晶体、原子晶体中一定含有共价键,离子晶体一定含有离子键 |
| D、某非金属元素从游离态变成化合态时,该元素一定被还原 |
煤中含有的硫在燃烧时以二氧化硫的形式排放到大气中,会导致酸雨.工业上常在煤中加入一些物质或将燃烧尾气进行集中处理以控制和消除其对大气的影响.下列物质中,不能用于控制和消除二氧化硫对大气影响的是( )
| A、氨水 | B、石英 |
| C、石灰石 | D、熟石灰 |
下列做法正确的是( )
| A、不慎接触过多的氨,及时吸入新鲜的空气和水蒸气,并用大量水冲洗眼睛 |
| B、配制稀硫酸时,向浓硫酸中加入水进行稀释 |
| C、高锰酸钾加热制氧气实验结束时,不慎出现倒吸现象,应立即松开试管上的橡皮塞 |
| D、检验H2纯度时,用排空气法收集H2 |
对于反应3Cl2+6NaOH
5NaCl+NaClO3+3H2O,以下叙述正确的是( )
| ||
| A、Cl2是氧化剂,NaOH是还原剂 |
| B、被氧化的氯原子和被还原的氯原子的物质的量之比为5:1 |
| C、NaCl是氧化产物 |
| D、氧化剂得电子数与还原剂失电子数之比为1:1 |
 .下列化合物中,不能与2一奈酚互为同分异构体的是( )
.下列化合物中,不能与2一奈酚互为同分异构体的是( )



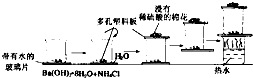 某同学设计如图的实验方案来探究NH4Cl和Ba(OH)2?8H2O反应中的能量变化.根据他的实验步骤填写对应的实验现象和结论.
某同学设计如图的实验方案来探究NH4Cl和Ba(OH)2?8H2O反应中的能量变化.根据他的实验步骤填写对应的实验现象和结论.