��Ŀ����
����Ŀ��SO2�ĺ����ǿ��������ձ���һ����Ҫ���ָ�꣬Ҳ���������������Ű�ҹ��ֵ�������Ҫԭ��֮һ���Ӵ�SO2�Ĵ������ȣ�������������Ⱦ�ĵ���֮����
I���绯ѧ������SO2��
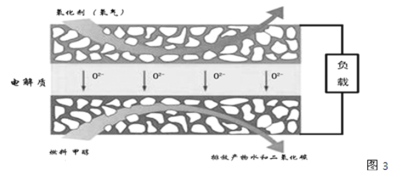
���Ṥҵβ���е�SO2������������Ʊ����ᣬͬʱ��õ��ܣ�װ������ͼ��ʾ���缫��Ϊ���Բ��ϣ���

��1��M�������ĵ缫��ӦʽΪ________________��
��2����ʹ��װ�õĵ���ǿ�ȴﵽ2��0A��������ÿ����Ӧ��ͨ���״������������Ϊ________L����֪��1��e-��������Ϊ1.6��10-19C����
��.��Һ��绯ѧ�ۺϣ��Ƽ�ѭ����������SO2��
��3���Ƽ�ѭ�����У���Na2SO3��Һ��Ϊ����Һ������SO2���÷�Ӧ�����ӷ���ʽΪ______________��
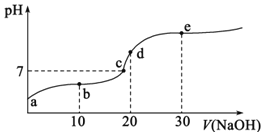
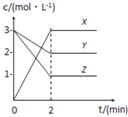
��4������Һ����SO2�Ĺ����У�pH��n(SO32-)��n(HSO3-)�仯��ϵ����ͼ��ʾ��
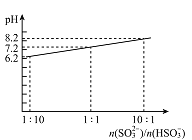
����ͼ�����ݺͱ仯����˵��NaHSO3��Һ�����Ե�ԭ��________________��
��n(SO32-)��n(HSO3-)=1��1ʱ����Һ������Ũ���ɴ�С��˳����_____________��
��5��������Һ��pH����ԼΪ6ʱ�����������۴�����ֱ���õ�pH>8������Һ��ѭ�����ã�����ʾ��ͼ���£�
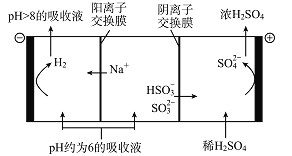
��д�����������ĵ缫��Ӧʽ________________��
�ڵ��缫����2 mol����ת��ʱ�������������Ϊ______________��
���𰸡�SO2��2H2O��2e��=SO42����4H�� 0. 014 SO32����SO2��H2O=2HSO3�� ����n(SO32��)/n(HSO3��)�ļ�С��pH��С����n(SO32��)/c(HSO3��)=1��10ʱ��pH=6.2���ѳ����ԣ���ΪNaHSO3��Һʱ��pHһ��С��6.2 c(Na��)>c(SO32��)=c(HSO3��)>c(OH��)>c(H��) HSO3����H2O��2e��=SO42����3H�� 2.0g
��������
��1������ԭ��صĹ���ԭ����ͼʾ��M��ͨ���SO2����ʧ���ӵ�������Ӧ�������ᣬM��Ϊ���������M���ĵ缫��ӦʽΪ��SO2��2H2O��2e��=SO42����4H����
��2����ʹ��װ�õĵ���ǿ�ȴﵽ2.0A��������ÿ����ͨ���ĵ������ʵ���Ϊ2.0A��60s��(1.6��10-19C)��(6.02��1023mol-1)=1.246��10-3mol�����ݵ缫��ӦʽSO2��2H2O��2e��=SO42����4H������״������ͨ��SO2�����V(SO2)=![]() n��e-����22.4L/mol=
n��e-����22.4L/mol=![]() ��1.246��10-3mol��22.4L/mol= 0.014L��
��1.246��10-3mol��22.4L/mol= 0.014L��
��3��Na2SO3��Һ����SO2����NaHSO3����Ӧ�����ӷ���ʽΪSO2��SO32����H2O=2HSO3����
��4���ٸ���ͼ�����ݱ仯���ó�������n(SO32��)/n(HSO3��)�ļ�С��pH��С����n(SO32��)/c(HSO3��)=1��10ʱ��pH=6.2���ѳ����ԣ���ΪNaHSO3��Һʱ��pHһ��С��6.2��
�ڸ���ͼ���֪��n(SO32-)/n(HSO3-)=1��1ʱ����Һ�Լ��ԣ���c(OH��)>c(H��)��Na����ˮ�⣬�������Ũ�ȴ�С��c(Na��)>c(SO32��)=c(HSO3��)>c(OH��)>c(H��)��
��5���ٸ��ݵ��ʾ��ͼ��������HSO3-ʧ���ӷ���������Ӧ����SO42-���缫��ӦʽΪ��H2O��HSO3����2e��=SO42����3H����
�ڸ���ͼʾ�����������ĵ缫��ӦʽΪ��2H2O��2e��=H2����2OH����ת��2mol��������1mol���������õ�2g������