题目内容
物质具有导电性需要满足什么条件?
解析:
|
物质具有导电性,必须有能够自由移动的带电微粒,这样,当存在外加电场时,这些带电微粒就发生定向移动,从而产生电流.金属具有导电性,是因为金属中金属原子释放出许多自由电子(金属原子变为阳离子),虽然金属阳离子不能移动,但自由电子可以在整个金属内部自由移动,当通电时,电子由负极向阳极做定向移动,从而导电.像氯化钠一样的离子晶体,晶体中虽然有带电微粒(Na+、Cl-),但是,在固态时,Na+和Cl-不能移动,即使通电也是如此,所以不导电.但是,如果加热将氯化钠熔化呈液态,因液态物质具有流动性,Na+和Cl-就能自由移动了,因而能够导电;H2SO4、HCl等强酸,虽然本身不存在带电微粒,但是在溶于水的时候,也可以在水分子作用下离解为H+、 |

 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“外界条件对化学反应速率的影响”。实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢。该小组设计了如下方案:
|
实验编号 |
H2C2O4溶液 |
酸性KMnO4溶液 |
温度 |
||
|
浓度(mol·L-1) |
体积(mL) |
浓度(mol·L-1) |
体积 (mL) |
||
|
① |
0.10 |
2.0 |
0.010 |
4.0 |
25 |
|
② |
0.20 |
2.0 |
0.010 |
4.0 |
25 |
|
③ |
0.20 |
2.0 |
0.010 |
4.0 |
50 |
(1)已知反应后H2C2O4转化为CO2逸出,KMnO4转化为MnSO4,每消耗1molH2C2O4转移_______mol电子。为了观察到紫色褪去,H2C2O4与KMnO4初始的物质的量需要满足的关系为n(H2C2O4)∶n(KMnO4)≥______。
(2)探究温度对化学反应速率影响的实验编号是________(填编号,下同),可探究反应物浓度对化学反应速率影响的实验编号是________。
(3)实验①测得KMnO4溶液的褪色时间为40s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMnO4)=________mol·L-1·min-1。
(4)已知实验③中c(MnO4-)~反应时间t的变化曲线如下图。若保持其他条件不变,请在图中画出实验②中c(MnO4-)~t的变化曲线示意图。
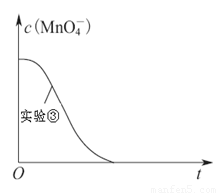
某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“条件对化学反应速率的影响”。实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢。该小组设计了如下的方案。
|
编号 |
H2C2O4溶液 |
酸性KMnO4溶液 |
温度/℃ |
||
|
浓度/ mol•L-1 |
体积/mL |
浓度/ mol•L-1 |
体积/mL |
||
|
① |
0.10 |
2.0 |
0.010 |
4.0 |
25 |
|
② |
0.20 |
2.0 |
0.010 |
4.0 |
25 |
|
③ |
0.20 |
2.0 |
0.010 |
4.0 |
50 |
(1)已知反应后H2C2O4转化为CO2逸出,KMnO4转化为MnSO4,每消耗1mol H2C2O4转移_____mol 电子。为了观察到紫色褪去,H2C2O4与KMnO4初始的物质的量需要满足的关系为:c(H2C2O4)∶c(KMnO4) ≥______________。
(2)探究温度对化学反应速率影响的实验编号是___________(填编号,下同),可探究反应物浓度对化学反应速率影响的实验编号是_____________。
(3)实验①测得KMnO4溶液的褪色时间为40s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMnO4)=_______________ mol•L-1•min-1。
(4)已知50℃时c(MnO4-)~反应时间t的变化曲线如图。若保持其他条件不变,请在答题卡坐标图中,画出25℃时c(MnO4-)~t的变化曲线示意图。

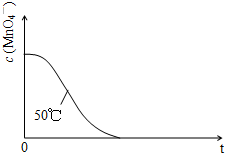 (2013?广州模拟)某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“条件对化学反应速率的影响”.实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢.该小组设计了如下的方案.
(2013?广州模拟)某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“条件对化学反应速率的影响”.实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢.该小组设计了如下的方案. H2 (g) +CO2
(g)平衡常数K随温度的变化如下表:
H2 (g) +CO2
(g)平衡常数K随温度的变化如下表:
 2C0
Cg)平衡常数K1;
2C0
Cg)平衡常数K1; CO
Cg) +H2 (g)平衡常数K2
CO
Cg) +H2 (g)平衡常数K2
