题目内容
一定温度下,在容积一定的容器中,可逆反应A(s)+3B(g)?3C(g)达到平衡的标志是( )
分析:达到反应平衡状态时,在一定条件下的可逆反应里,正反应速率和逆反应速率相等,反应混合物中各组成成分的百分含量保持不变,该反应就达到平衡状态,据此分析解答.
解答:解:A、容器内每减少1mol A,同时生成3mol C,都是表示正反应速率,无法判断正逆反应速率是否相等,反应是否达到平衡状态,故A错误;
B、容器内每减少1mol A,同时消耗3mol B,表示的都是正反应速率,无法判断正逆反应速率是否相等,各组分浓度是否不变,故B错误;
C、反应方程式两边气体的化学计量数之和相等,气体的总物质的量始终不变,所以混合气体总的物质的量不变,无法判断是否达到平衡状态,故C错误;
D、由于反应方程式两边气体的质量不相等,只有达到了平衡状态,容器内的气体密度才能不变化,故D正确;
故选D.
B、容器内每减少1mol A,同时消耗3mol B,表示的都是正反应速率,无法判断正逆反应速率是否相等,各组分浓度是否不变,故B错误;
C、反应方程式两边气体的化学计量数之和相等,气体的总物质的量始终不变,所以混合气体总的物质的量不变,无法判断是否达到平衡状态,故C错误;
D、由于反应方程式两边气体的质量不相等,只有达到了平衡状态,容器内的气体密度才能不变化,故D正确;
故选D.
点评:本题考查化学平衡状态的判断,题目难度不大,注意反应前的计量数等于反应后各物质的计量数之和,但反应前后气体的物质的量发生改变.

练习册系列答案
相关题目
(14分)研究CO2的利用对促进低碳社会的构建具有重要的意义。
(1)已知石墨的标准燃烧热为y kJ·mol-1,1.2g石墨在1.68L(标准状况)氧气中燃烧,至反应物耗尽,放出x kJ热量。则石墨与氧气反应生成CO的热化学方程式为 ,
(2)高温时,用CO还原MgSO4可制备高纯MgO。
①750℃时,测得气体中含等物质的量SO2和SO3,此时反应的化学方程式是 。
②由MgO可制成“镁—次氯酸盐”燃料电池,其装置示意图如图1,该电池反应的离子方程式为 。 


图1 图2 图3
(3)二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为:
CO2(g) +3H2(g)  CH3OH(g) +H2O(g) △H
CH3OH(g) +H2O(g) △H
①该反应的平衡常数表达式为K= 。
②取五份等体积CO2和H2的混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如图2所示,则上述CO2转化为甲醇反应的ΔH (填“>” “<”或“=”)0。
③在两种不同条件下发生反应,测得CH3OH的物质的量随时间变化如图3所示,曲线I、Ⅱ对应的平衡常数大小关系为KⅠ KⅡ(填“>” “<”或“=”)。
④一定温度下,在容积相同且固定的两个密闭容器中,按如下方式投入反应物,一段时间后达到平衡。
| 容 器 | 甲 | 乙 |
| 反应物 投入量 | 1molCO2 3molH2 | a molCO2、b molH2、 c molCH3OH(g)、c molH2O(g) |
若甲中平衡后气体的压强为开始时的0.8倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持反应逆向进行,则c的取值范围为 。

 研究CO2的利用对促进低碳社会的构建具有重要的意义.
研究CO2的利用对促进低碳社会的构建具有重要的意义. 一定温度下,在容积固定的V L密闭容器里加入n mol A、2n mol B,发生反应:A(g)+2B(g)
一定温度下,在容积固定的V L密闭容器里加入n mol A、2n mol B,发生反应:A(g)+2B(g)  2NH3(g);ΔH =" -92.2" kJ·mol-1。
2NH3(g);ΔH =" -92.2" kJ·mol-1。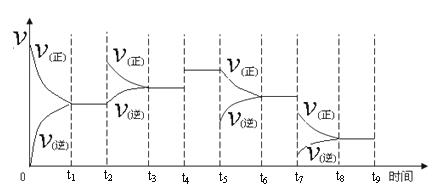
 H2(g) + CO(g) △H =" +131.3" kJ/mol
H2(g) + CO(g) △H =" +131.3" kJ/mol