题目内容
下列反应的离子方程式正确的是( )
A、向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O
| ||||
B、电解饱和氯化铝溶液:2Cl-+2H2O
| ||||
C、实验室用浓盐酸与MnO2反应制Cl2:MnO2+2H++2Cl-
| ||||
| D、向 NaHS 溶液中通入适量氯气:HS-+Cl2═S↓+H++2Cl- |
考点:离子方程式的书写
专题:离子反应专题
分析:A.胶体不写沉淀符号;
B.还生成氢氧化铝沉淀;
C.原子不守恒、电荷不守恒;
D.二者反应生成S、HCl和NaCl.
B.还生成氢氧化铝沉淀;
C.原子不守恒、电荷不守恒;
D.二者反应生成S、HCl和NaCl.
解答:
解:A.胶体不写沉淀符号,离子方程式为Fe3++3H2O
Fe(OH)3(胶体)+3H+,故A错误;
B.还生成氢氧化铝沉淀,离子方程式为2Al3++6Cl-+6H2O
3H2↑+3Cl2↑+Al(OH)3↓,故B错误;
C.原子不守恒、电荷不守恒,离子方程式为MnO2+4H++2Cl-
Cl2↑+Mn2++2H2O,故C错误;
D.二者反应生成S、HCl和NaCl,离子方程式为HS-+Cl2═S↓+H++2Cl-,故D正确;
故选D.
| ||
B.还生成氢氧化铝沉淀,离子方程式为2Al3++6Cl-+6H2O
| ||
C.原子不守恒、电荷不守恒,离子方程式为MnO2+4H++2Cl-
| ||
D.二者反应生成S、HCl和NaCl,离子方程式为HS-+Cl2═S↓+H++2Cl-,故D正确;
故选D.
点评:本题考查离子方程式正误判断,明确物质性质及离子方程式书写规则是解本题关键,常常涉及氧化还原反应、盐类水解等知识点,注意A中胶体不能写沉淀符号、注意B中铝离子和氢氧根离子反应,这些都是易错点.

练习册系列答案
 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案
相关题目
把1mol甲烷和4mol氯气组成的混合气体充入到大试管中将此试管倒立在盛有饱和食盐水的水槽里,放在光亮处,一段时间后,推测可能观察到的现象( )
①黄绿色逐渐消失 ②试管壁上有油珠 ③试管内水面上升 ④水槽内有少量晶体析出.
①黄绿色逐渐消失 ②试管壁上有油珠 ③试管内水面上升 ④水槽内有少量晶体析出.
| A、只有①③ | B、只有①②③ |
| C、只有①③④ | D、①②③④ |
某种干洗剂的主要成分是四氯乙烯(CCl2=CCl2),对人体有害.家用不粘锅内涂覆物质的主要成分是聚四氟乙烯,对人体无害.下列关于四氯乙烯和聚四氟乙烯的叙述中正确的是( )
| A、它们都属于烃 |
| B、它们的分子中都不含氢原子 |
| C、它们都能使酸性KMnO4溶液褪色 |
| D、它们都可由乙烯只发生加成反应制得 |
下列仪器中,不能用来震荡或摇匀液体的是( )
A、 |
B、 |
C、 |
D、 |
下列各组物质中,互为同系物的是( )
A、CH3-CH=CH2和 |
B、 和 和 |
C、 和 和 |
| D、CH2=CH-CH=CH2和CH3-CH2-CH2-C≡CH |
有机反应的类型很多,下列各反应中与CH2═CH2-→CH2Br-CH2Br的变化属于同一反应类型的是( )
| A、CH3CHO→C2H5OH |
| B、CH3COOH→CH3COOC2H5 |
C、 |
| D、C2H5Br→CH2═CH2 |
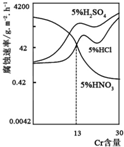 如图是三种酸对Fe-Cr合金随Cr含量变化的腐蚀性实验结果,下列有关说法正确的是( )
如图是三种酸对Fe-Cr合金随Cr含量变化的腐蚀性实验结果,下列有关说法正确的是( )| A、稀硫酸对Fe-Cr合金的腐蚀性比稀硝酸和稀盐酸都强 |
| B、随着Fe含量的增加,Fe-Cr合金在5%HNO3中的耐腐蚀性越来越弱 |
| C、Cr含量等于13%时,三种酸对Fe-Cr合金的腐蚀速率由快到慢的顺序为H2SO4>HCl>HNO3 |
| D、Cr含量小于13%时,因为三种酸中硫酸的氢离子浓度最大,所以对Fe-Cr合金的腐蚀性最强 |
反应4A(g)+5B(g)═4C(g)+6D(g)在某密闭容器中进行,半分钟后,C的物质的量浓度增加了0.3mol/L.下列论述正确的是( )
| A、半分钟内的平均反应速率:5v(B)=6v(D) |
| B、C的平均反应速率是0.010 mol?L-1?s-1 |
| C、容器中含D的物质的量至少为0.45mol |
| D、容器中A的物质的量浓度增加了0.3mol/L |
2008年11月18日国际著名血液学杂志《BLOOD》刊载了一条令人振奋的科研成果:中国科学家找到白血病致病元凶-蛋白质Shp-2.下列关于蛋白质Shp-2的说法正确的是( )
| A、它是纯净物 |
| B、在一定条件下能水解最终生成氨基酸 |
| C、天然蛋白质仅由碳、氢、氧、氮四种元素组成 |
| D、氨基酸和蛋白质shp-2都只能与碱反应 |