题目内容
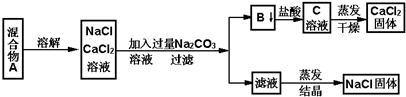
“烂版液”是制印刷锌板时,用稀硝酸腐蚀锌板后得到的“废液”(含有少量的Cl-、Fe3+),某化学兴趣小组拟用“烂版液”制取Zn(NO3)2?6H2O的过程如下:
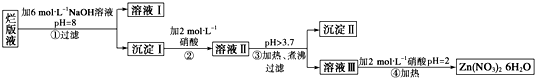
已知:Zn(NO3)2?6H2O是一种无色晶体,水溶液呈酸性,Zn(NO3)2能与碱反应,得到的产物具有两性.
(1)“烂版液”中溶质的主要成分是 (填化学式).
(2)若稀硝酸腐蚀锌板产生的气体为N2O,写出稀硝酸腐蚀锌板反应的主要化学方程式 .
(3)在操作①中保持pH=8的目的是 .
(4)沉淀Ⅰ的主要成分是 .
(5)操作③中加热、煮沸的目的是 ;此步骤操作的理论依据是 .
(6)操作④保持pH=2的目的是 ;此步骤操作中所用的主要仪器是 .

已知:Zn(NO3)2?6H2O是一种无色晶体,水溶液呈酸性,Zn(NO3)2能与碱反应,得到的产物具有两性.
(1)“烂版液”中溶质的主要成分是
(2)若稀硝酸腐蚀锌板产生的气体为N2O,写出稀硝酸腐蚀锌板反应的主要化学方程式
(3)在操作①中保持pH=8的目的是
(4)沉淀Ⅰ的主要成分是
(5)操作③中加热、煮沸的目的是
(6)操作④保持pH=2的目的是
考点:物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:“烂板液”中含有大量的锌离子、氢离子、硝酸根离子和少量的Cl-、Fe3+,加入氢氧化钠调节溶液的PH=8使铁离子、锌离子完全沉淀,然后在沉淀Ⅰ中加硝酸溶解,溶液Ⅱ中含有大量锌离子、氢离子、硝酸根离子和少量的铁离子,调节溶液的PH使铁离子沉淀,溶液Ⅲ是硝酸锌溶液,在酸性条件下加热浓缩蒸发结晶,得到Zn(NO3)2?6H2O是一种无色晶体.
(1)烂板液”中溶质的主要成分是Zn(NO3)2;
(2)此时硝酸很稀,硝酸中的氮被还原+1价为N2O,Zn被氧化为Zn(NO3)2;
(3)使锌离子完全转化为氢氧化锌,pH不大,如果pH加大氢氧化锌两性又溶解;
(4)Zn2+、Fe3+完全沉淀生成相应的氢氧化物;
(5)热煮沸促使Fe3+完全水解;
(6)锌离子易水解生成氢氧化锌,操作④包括蒸发浓缩,冷却结晶,过滤.
(1)烂板液”中溶质的主要成分是Zn(NO3)2;
(2)此时硝酸很稀,硝酸中的氮被还原+1价为N2O,Zn被氧化为Zn(NO3)2;
(3)使锌离子完全转化为氢氧化锌,pH不大,如果pH加大氢氧化锌两性又溶解;
(4)Zn2+、Fe3+完全沉淀生成相应的氢氧化物;
(5)热煮沸促使Fe3+完全水解;
(6)锌离子易水解生成氢氧化锌,操作④包括蒸发浓缩,冷却结晶,过滤.
解答:
解:“烂板液”中含有大量的锌离子、氢离子、硝酸根离子和少量的Cl-、Fe3+,加入氢氧化钠调节溶液的PH=8使铁离子、锌离子完全沉淀,然后在沉淀Ⅰ中加硝酸溶解,溶液Ⅱ中含有大量锌离子、氢离子、硝酸根离子和少量的铁离子,调节溶液的PH使铁离子沉淀,溶液Ⅲ是硝酸锌溶液,在酸性条件下加热浓缩蒸发结晶,得到Zn(NO3)2?6H2O是一种无色晶体.
(1)烂板液”中溶质的主要成分是Zn(NO3)2,故答案为:Zn(NO3)2;
(2)此时硝酸很稀,硝酸中的氮被还原+1价,硝酸中的氮被还原+1价为N2O,Zn被氧化为Zn(NO3)2,发生的化学反应为4Zn+10HNO3=4Zn(NO3)2+N2O↑+5H2O;
故答案为:4Zn+10HNO3=4Zn(NO3)2+N2O↑+5H2O;
(3)使锌离子完全转化为氢氧化锌,PH不大,如果PH加大氢氧化锌两性又溶解,故答案为:防止生成的Zn(OH)2溶解;
(4)Zn2+、Fe3+完全沉淀生成相应的氢氧化物,故答案为:Fe(OH)3和Zn(OH)2;
(5)热煮沸促使Fe3+完全水解,原理是温度越高,水解程度越大,故答案为:促进Fe3+完全水解;水解反应吸热,温度高,水解程度大;
(6)锌离子易水解生成氢氧化锌,酸性条件下可抑制锌离子的水解,则操作④保持pH=2的目的是抑制Zn2+水解为Zn(OH)2;操作④包括蒸发浓缩,冷却结晶,过滤,所用的主要仪器有蒸发皿、酒精灯、铁架台、玻璃棒,
故答案为:抑制Zn2+水解为Zn(OH)2;蒸发皿、酒精灯、铁架台、玻璃棒.
(1)烂板液”中溶质的主要成分是Zn(NO3)2,故答案为:Zn(NO3)2;
(2)此时硝酸很稀,硝酸中的氮被还原+1价,硝酸中的氮被还原+1价为N2O,Zn被氧化为Zn(NO3)2,发生的化学反应为4Zn+10HNO3=4Zn(NO3)2+N2O↑+5H2O;
故答案为:4Zn+10HNO3=4Zn(NO3)2+N2O↑+5H2O;
(3)使锌离子完全转化为氢氧化锌,PH不大,如果PH加大氢氧化锌两性又溶解,故答案为:防止生成的Zn(OH)2溶解;
(4)Zn2+、Fe3+完全沉淀生成相应的氢氧化物,故答案为:Fe(OH)3和Zn(OH)2;
(5)热煮沸促使Fe3+完全水解,原理是温度越高,水解程度越大,故答案为:促进Fe3+完全水解;水解反应吸热,温度高,水解程度大;
(6)锌离子易水解生成氢氧化锌,酸性条件下可抑制锌离子的水解,则操作④保持pH=2的目的是抑制Zn2+水解为Zn(OH)2;操作④包括蒸发浓缩,冷却结晶,过滤,所用的主要仪器有蒸发皿、酒精灯、铁架台、玻璃棒,
故答案为:抑制Zn2+水解为Zn(OH)2;蒸发皿、酒精灯、铁架台、玻璃棒.
点评:本题考查了物质的分离提纯实验操作,涉及氢氧化锌的两性、过滤的仪器、沉淀的生成、盐类的水解等,难度中等,注意锌离子易水解生成氢氧化锌,酸性条件下可抑制锌离子的水解.

练习册系列答案
 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案
相关题目
已知Fe(OH)3胶粒带正电荷,Al(OH)3胶粒也带正电荷,而H2SiO3胶粒带负电荷,带不同电荷的胶体相互混合时,则发生聚沉现象.据此回答下列问题:将某溶液逐滴加入Fe(OH)3溶胶内,开始时产生沉淀,继续滴加时沉淀溶解,该溶液是( )
| A、2 mol?L-1H2SO4溶液 |
| B、2 mol?L-1NaOH溶液 |
| C、2 mol?L-1MgSO4溶液 |
| D、硅酸溶胶 |
下列各组中的两种溶液,不用其它试剂就可以鉴别开的是( )
①H3PO4,Ba(OH)2 ②FeCl3,NaOH ③NaOH,AlCl3 ④NaAlO2,HCl⑤AgNO3,氨水.
①H3PO4,Ba(OH)2 ②FeCl3,NaOH ③NaOH,AlCl3 ④NaAlO2,HCl⑤AgNO3,氨水.
| A、全部 | B、②③④ |
| C、②③ | D、③④⑤ |
现有NaOH、Na2CO3、Ba(OH)2三种无色溶液,下列哪种试剂能将这三种物质鉴别( )
| A、NH4Cl |
| B、H2SO4 |
| C、AgNO3 |
| D、CuCl2 |