题目内容
【题目】A、B、C、D、E为原子序数依次增大的五种前四周期元素。A的核外电子总数与其 周期数相同;B的价电子排布式为nsnnpn+2;C、D为同周期元素,C是同周期元素中离子半径最小的元素,D元素最外层有一个未成对电子;E位于元素周期表的第四周期第IVB族,常用加热ED4溶液的方法制备纳米材料。
回答下列问题:
(1)D原子的价电子排布图为___________,E原子核外有_____个未成对电子,五种元素中电负性最大的是___________(填元素符号)。
(2)化合物D2B的中心原子的杂化方式为______________,它的VSEPR模型名称____________,分子的立体构型为_____________。
(3)与分子晶体D2B3互为等电子体的一种分子为____________(填化学式)。
(4)由A、B、D三种元素所形成的一系列化合物中氧化性最强的是_______(填化学式,下同),酸性最强的是_________________。
(5)单质B有两种同素异形体,其中沸点高的是______(填分子式),原因是__________。
(6)C与D能形成化合物Q。在1.01×105Pa、T1℃时,气体摩尔体积为53.4L/mol,实验测得Q的气态密度为5.00g/L,则此时Q的化学式为____________________。
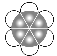
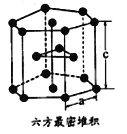
(7)E单质有两种同素异形体,高温下是体心立方堆积,但在常温下的晶体结构为如图所示的六方最密堆积。已知晶胞参数分别为acm和ccm,则该晶体的密度可表示为______g·cm-3。(用含a和c的式子表示,用NA表示阿伏伽德罗常数的值)。
 。
。
【答案】![]() 2Osp3杂化正四面体V形CCl4HClOHClO4O3相对分子质量越大,熔沸点越高Al2Cl6
2Osp3杂化正四面体V形CCl4HClOHClO4O3相对分子质量越大,熔沸点越高Al2Cl6![]()
【解析】
A、B、C、D、E为原子序数依次增大的五种前四周期元素。B的价电子排布式为nsnnpn+2,s轨道最多可以排布2个电子,所以n=2,则B的价电子排布式为2s22p4,即B为O元素;A的核外电子总数与其周期数相同且原子序数小于B,则A为氢元素;C、D为同周期元素,C是同周期元素中离子半径最小的元素,则C为铝元素;D元素最外层有一个未成对电子,则D为氯元素;E位于元素周期表的第四周期第IVB族,则E为Ti元素。
(1)D为17号的氯元素,原子的价电子排布图为![]() ,E为Ti元素,基态原子电子排布式为1s22s22p63s23p63d24s2,原子核外有2个未成对电子。元素非金属性越强电负性越大,则五种元素中电负性最大的是O;
,E为Ti元素,基态原子电子排布式为1s22s22p63s23p63d24s2,原子核外有2个未成对电子。元素非金属性越强电负性越大,则五种元素中电负性最大的是O;
(2)化合物D2B为Cl2O,中心原子O原子和氯原子形成2个σ键,孤电子对个数=![]() ×(6-2×1)=2,价层电子对数为=2+2=4,为sp3杂化,故其VSEPR模型为正四面体,含2对孤电子对,分子立体构型为V形;
×(6-2×1)=2,价层电子对数为=2+2=4,为sp3杂化,故其VSEPR模型为正四面体,含2对孤电子对,分子立体构型为V形;
(3)等电子体是指价电子数和原子数相同的分子、离子或原子团。与分子晶体D2B3互为等电子体的一种分子为CCl4;
(4)由A、B、D三种元素所形成的一系列化合物HClO4、HClO3、HClO2、HClO中氧化性最强的是HClO,酸性最强的是HClO4;
(5)单质B有两种同素异形体,其中沸点高的是O3,原因是结构相似的分子晶体中相对分子质量越大,熔沸点越高;
(6)C与D能形成化合物Q。根据铝和氯的化合价可设Q为(AlCl3) n,在1.01×105Pa、T1℃时,气体摩尔体积为53.4L/mol,实验测得Q的气态密度为5.00g/L,则M=![]() , 则133.5n=267,解得n=2,此时Q的化学式为Al2Cl6;
, 则133.5n=267,解得n=2,此时Q的化学式为Al2Cl6;
(7)在常温下的晶体结构为如图所示的六方最密堆积,根据均摊法可知含有钛原子个数为12![]() 。已知晶胞参数分别为acm和ccm,则晶胞的底面积为
。已知晶胞参数分别为acm和ccm,则晶胞的底面积为![]() ,体积为
,体积为![]() ,该晶体的密度可表示为
,该晶体的密度可表示为![]() =
=![]() g·cm-3。
g·cm-3。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案