��Ŀ����
��ҵ�����������ԭ�ϣ�һ���ǻ���������Ҫ�ɷ�ΪFeS2��SΪ-1�ۣ�����һ���ǴŻ���������Ҫ�ɷ���Fe1-xS��SΪ-2�ۣ���ʽ��xͨ��Ϊ0.1~0.2���Ⱥ���Fe2���ֺ���Fe3����
��������ʱ����ʯ���գ�������Ӧ���£�
�� 4 FeS2 + 11 O2 �� 2 Fe2O3 + 8 SO2
�� 4 Fe1-xS + (7-3x) O2 �� 2 (1-x) Fe2O3 + 4 SO2
��1����FeS2 72%�Ļ�����10�֣�����������������98%��Ũ���� �֣���ʯ���������������ʣ���
��2�����Ż�����Fe1-xS��x=0.1����Fe1-xS��Fe2����Fe3�������ʵ���֮��Ϊ ��1��
��3�����տ�ʯʱ��Ϊ�˾����ܵؽ���ʯ�е���ת��ΪSO2����ͨ�����20%�Ŀ���������N2��O2�������Ϊ4��1����������������ɷ֣�������Ż����������պ��ų���������SO2������������ú�x�Ĵ���ʽ��ʾ����
��4����һ�����ĴŻ������������������ᣬ��ַ�Ӧ��������S����2.4g��FeCl2 0.425mol������Һ����Fe3��������Fe1-xS�е�xֵ����ʯ�������ɷֲ������ᷴӦ����
��1��12 ��2�֣�
��2��3.5 ��3�֣�
��3�� ��3�֣�
��3�֣�
��4��0.15 ��4�֣�
��������
���������
��1�����ݹ�ϵʽ�У�FeS2~2H2SO4��
120 196
10t��72% x��98% ���x=12t��
��2���������Ϊxmol��������Ϊymol������x+y=0.9��2x+3y=2�����x=0.7��y=0.2����Ϊ3.5:1��
��3���⣺������4mol SO2������Ҫ1.2 (7-3x)mol��O2����������е�N2Ϊ4.8 (7-3x)mol��
��Ӧ��õ��Ļ���������Ϊ��SO2 4mol��O2 0.2 (7-3x)mol��N2 4.8 (7-3x)mol��
�� SO2���������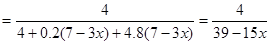
��4���ⷨһ����2Fe3��~S����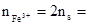 0.15mol
0.15mol
����ԭ���غ�ã�Fe1-xS��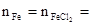 0.425mol��
0.425mol��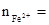 0.275mol
0.275mol
�ɻ��ϼ۵ã� ��0.275
��0.275 2
2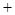 0.15
0.15 3��
3��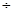 2
2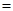 0.5mol
0.5mol
��  ��
�� 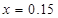
�ⷨ����Fe1-xS + HCl �� FeCl2 + H2S��+ S��
��ԭ���غ�ã�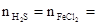 0.425mol ����������Ԫ�ط�Ӧ����H2S�У���Ԫ����FeCl2�У�
0.425mol ����������Ԫ�ط�Ӧ����H2S�У���Ԫ����FeCl2�У�
�� Fe1-xS�� ��Ԫ��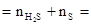 0.075+0.425=0.5mol ��Ԫ��
0.075+0.425=0.5mol ��Ԫ��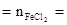 0.425mol
0.425mol
��  ��
�� 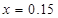
���㣺��ѧ���㣬�غ㷨����ϵʽ����

 2S03��g����H3=mkJ/mol��ƽ�ⳣ����K���Ĵ�С���¶ȣ�T���Ĺ�ϵ����ͼ��������ʾ����m____0���>����=����<������b��ʱv������ v���棩���<������=����>��������Ӧ���ʱ䣨��H���� �����������С�����䡱����
2S03��g����H3=mkJ/mol��ƽ�ⳣ����K���Ĵ�С���¶ȣ�T���Ĺ�ϵ����ͼ��������ʾ����m____0���>����=����<������b��ʱv������ v���棩���<������=����>��������Ӧ���ʱ䣨��H���� �����������С�����䡱���� NH3��H2O+H+����÷�Ӧ�����µ�ƽ�ⳣ��K= ����֪�������£�NH3��H2O�ĵ���ƽ�ⳣ��K=1. 7��10-5��
NH3��H2O+H+����÷�Ӧ�����µ�ƽ�ⳣ��K= ����֪�������£�NH3��H2O�ĵ���ƽ�ⳣ��K=1. 7��10-5��