题目内容
【题目】回答下问题:
(1)下列说法不正确的是(填字母序号).
A.铝的氧化物属于碱性氧化物
B.光纤制品的基本原料为SiO2
C.用热的纯碱溶液洗涤沾有油污的器具时发生的主要是化学变化
D.液氨、液氯、液态氯化氢都是非电解质
E.丁达尔效应可用于区别溶液与胶体,云、雾均能产生丁达尔效应
F.化学变化前后原子的种类、数目不变,分子数目也不变
(2)出土的青铜器大多受到魂晶腐蚀,某青铜器中Sn、Pb的质量分别为119g、20.7g,则该青铜器中Sn和Pb原子的数目之比为采用“局部封闭法”可以防止青铜器进一步被腐蚀.如将糊状Ag2O涂在被腐蚀部位,Ag2O与有害组分CuCl发生复分解反应,该化学方程式为
(3)KNO3中NO3﹣的空间构型为 , 写出与NO3﹣互为等电子体的另一种阴离子的化学式:
(4)已知配合物CrCl36H2O中心原子Cr3+配位数为6,向含0.1molCrCl36H2O的溶液中滴加2mol/LAgNO3溶液,反应完全后共消耗AgNO3溶液50mL,则该配离子的化学式为
【答案】
(1)ADF
(2)10:1;Ag2O+2CuCl═2AgCl+Cu2O
(3)平面正三角形;CO32﹣
(4)[CrCl2(H2O)4]Cl?H2O
【解析】解:(1)A.铝的氧化物氧化铝属于两性氧化物,故错误;
B.SiO2是制造光导纤维的主要材料,即光纤制品的基本原料为SiO2 , 故正确;
C.用热的纯碱溶液洗涤沾有油污的器具,可以使油脂的水解进行的更加彻底,发生的主要是化学变化,故正确;
D.在水溶液和熔融状态下都不导电的化合物是非电解质,液氨是非电解质,液态氯化氢是电解质,故错误;
E.丁达尔效应可用于区别溶液与胶体,云、雾均属于胶体分散系,能产生丁达尔效应,故正确;
F.化学变化前后遵循元素守恒、质量守恒,化学变化前后原子的种类、数目不变,分子数目也不变,故正确.
故选ADF;
(2.)Sn、Pb的物质的量之比= ![]() :
: ![]() =1mol:0.1mol=10:1,根据N=nNA知,物质的量之比等于其个数之比,所以Sn、Pb原子个数之比为10:1,Ag2O与有害组分CuCl发生复分解反应,则二者相互交换成分生成另外的两种化合物,反应方程式为Ag2O+2CuCl=2AgCl+Cu2O,所以答案是:10:1; Ag2O+2CuCl═2AgCl+Cu2O;
=1mol:0.1mol=10:1,根据N=nNA知,物质的量之比等于其个数之比,所以Sn、Pb原子个数之比为10:1,Ag2O与有害组分CuCl发生复分解反应,则二者相互交换成分生成另外的两种化合物,反应方程式为Ag2O+2CuCl=2AgCl+Cu2O,所以答案是:10:1; Ag2O+2CuCl═2AgCl+Cu2O;
(3.)NO3﹣中N原子价层电子对=3+ ![]() (5+1﹣3×2)=3,且不含孤电子对,所以是平面三角形结构,NO3﹣中有4个原子,5+6×3+1=24个价电子,CO32﹣有4个原子,4+6×3+2=24个价电子,所以与N03﹣互为等电子体的另一种阴离子为CO32﹣ ,
(5+1﹣3×2)=3,且不含孤电子对,所以是平面三角形结构,NO3﹣中有4个原子,5+6×3+1=24个价电子,CO32﹣有4个原子,4+6×3+2=24个价电子,所以与N03﹣互为等电子体的另一种阴离子为CO32﹣ ,
所以答案是:平面正三角形;CO32﹣;
(4.)能和硝酸银反应生成白色沉淀的是配合物中外界氯离子,n(AgNO3)=2molL﹣1×0.1L=0.2mol,0.1molCrCl36H2O和0.2mol硝酸银反应生成氯化银沉淀,所以该配合物外界氯离子个数是2,配合物CrCl36H2O则有1个氯原子是配位原子,该配合物的配位数是6,所以有5个水分子是配体,则该配离子的化学式为:[[CrCl(H2O)5]Cl2H2O,
所以答案是:[[CrCl(H2O)5]Cl2H2O.
【考点精析】掌握物理变化与化学变化的区别与联系是解答本题的根本,需要知道化学变化本质:旧键断裂、新键生成或转移电子等;二者的区别是:前者无新物质生成,仅是物质形态、状态的变化.

 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案【题目】已知某气体反应的平衡常数可表示为K=c(CH3OCH3)c(H2O)/[c(CH3OH)]2 , 该反应在不同温度下的平衡常数:400℃,K=32;500℃,K=44.
请回答下列问题:
(1)写出上述反应的化学方程式
(2)该反应的正反应是反应(填“放热”或者“吸热”),
(3)已知在密闭容器中,测得某时刻各组分的浓度如下:
物质 | CH3OH(g) | CH3OCH3(g) | H2O(g) |
浓度/(molL﹣1) | 0.54 | 0.68 | 0.68 |
①此时系统温度400℃,比较正、逆反应速率的大小:v正v逆 (填“>”、“<”或“=”).
②若以甲醇百分含量为纵坐标,以温度为横坐标,此时反应点在图象的位置是图中点.比较图中B、D两点所对应的正反应速率BD(填“>”、“<”或“=”).理由是 . 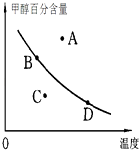
(4)一定条件下要提高反应物的转化率,可以采用的措施是
a.升高温度 b.加入催化剂 c.压缩容器的体积
d.增加水蒸气的浓度 e.及时分离出产物.