题目内容
用铁作阳极、石墨作阴极电解NaOH溶液,电极反应式别是:阳极
Fe-2e-=Fe2+
Fe-2e-=Fe2+
,阴极2H2O+2e-=H2↑+2OH-.
2H2O+2e-=H2↑+2OH-.
.溶液的PH变化是变大
变大
.若电解质溶液与空气接触,观察到的现象是先生成白色沉淀,迅速转变为灰绿色,最后变成红褐色
先生成白色沉淀,迅速转变为灰绿色,最后变成红褐色
,原因是4Fe(OH)2+O2+2H2O=4Fe(OH)3
4Fe(OH)2+O2+2H2O=4Fe(OH)3
(用化学方程式表示).当放出22.4升气体(标况),欲使溶液恢复原有组成应加入H2O
H2O
.其质量是45g
45g
.分析:电解池中,活泼金属作阳极时电极材料失电子变成离子进入溶液;根据溶液中阳离子的放电顺序判断阴极上发生的电极反应;根据溶液中氢氧根离子的浓度变化判断pH值的变化;二价铁离子和氢氧根离子能发生反应生成白色的氢氧化亚铁沉淀,白色的氢氧化亚铁沉淀不稳定,能迅速变为灰绿色,氢氧化亚铁和氧气能发生氧化还原反应生成红褐色氢氧化铁沉淀;根据溶液中变化的物质判断.
解答:解:电解池中,活泼金属作阳极时电极材料失电子变成离子进入溶液,电极反应式为 Fe-2e-=Fe2+;阴极上得电子反应还原反应,氢氧化钠溶液中氢离子的放电能力大于钠离子的放电能力,所以在阴极上析出氢气,电极反应式为2H2O+2e-=H2↑+2OH-;因氢气的析出,导致溶液中氢离子浓度小于氢氧根离子的浓度,所以溶液的PH值变大;二价铁离子和氢氧根离子能发生反应生成白色的氢氧化亚铁沉淀,白色的氢氧化亚铁沉淀不稳定,能迅速变为灰绿色,氢氧化亚铁和氧气能发生氧化还原反应生成红褐色氢氧化铁沉淀,反应方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3;该装置溶液的变化为:二价铁离子和氢氧根离子生成沉淀,阴极上析出氢气,氢氧化亚铁和水、氧气反应生成氢氧化铁沉淀也减少水的质量,所以实际上溶液减少物质为水,欲使溶液恢复原有组成应加入H2O;
设电解水的质量为xg.
2H2O+2e-=H2↑+2OH-.
36g 22.4L
xg 22.4L
x=36,所以电解水的质量为36g;根据得失电子守恒知,当生成22.4L气体时,生成二价铁离子的物质的量为1mol,再根据铁原子守恒,生成氢氧化亚铁的物质的量为1mol;
设与氢氧化亚铁反应的水的质量为yg.
4Fe(OH)2+O2+2H2O=4Fe(OH)3
4mol 36g
1mol yg
y=9
所以减少水的总质量为36g+9g=45g.
故答案为:Fe-2e-=Fe2+;2H2O+2e-=H2+2OH-;变大;先生成白色沉淀,迅速转变为灰绿色,最后变成红褐色;4Fe(OH)2+O2+2H2O+2e-=4Fe(OH)3;H2O;45g.
设电解水的质量为xg.
2H2O+2e-=H2↑+2OH-.
36g 22.4L
xg 22.4L
x=36,所以电解水的质量为36g;根据得失电子守恒知,当生成22.4L气体时,生成二价铁离子的物质的量为1mol,再根据铁原子守恒,生成氢氧化亚铁的物质的量为1mol;
设与氢氧化亚铁反应的水的质量为yg.
4Fe(OH)2+O2+2H2O=4Fe(OH)3
4mol 36g
1mol yg
y=9
所以减少水的总质量为36g+9g=45g.
故答案为:Fe-2e-=Fe2+;2H2O+2e-=H2+2OH-;变大;先生成白色沉淀,迅速转变为灰绿色,最后变成红褐色;4Fe(OH)2+O2+2H2O+2e-=4Fe(OH)3;H2O;45g.
点评:本题考查了电解原理,难度不大,易错之处是阳极电极反应式的书写、减少水的质量的计算,注意计算减少水的质量时不要忘记与氢氧化亚铁反应是水的质量.

练习册系列答案
相关题目
(12分)由周期表中前20号元素组成的单质X2、Y和化合物Z的有关信息如下表,X2、Y 和Z之间的转化关系如下图(其他无关物质已略去)。请回答下列问题:
| 单质X2 | 标准状况下密度为3.17 g?L-1 |
| 单质Y | 通常状况下为一种淡黄色固体 |
| 化合物Z | 焰色反应呈紫色(透过蓝色钴玻璃观察) |
| 常温下0.1 mol?L-1 Z的水溶液pH=13 |
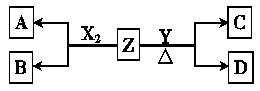
(1) Z的电子式为 。
(2)已知16 g固态单质Y在空气中完全燃烧放出148 kJ热量,则该反应的热化学方程式为 。
(3)已知C能与稀硫酸反应生成能使品红溶液褪色的气体,D中所含阴、阳离子的电子层排布相同。
①常温下D的水溶液pH>7,其原因是(用离子方程式表示) 。
②将20 mL 0.5 mol?L-1 C溶液逐滴加入20 mL 0.2 mol?L-1 KMnO4溶液(硫酸酸化)中,溶液恰好变为无色。写出该反应的离子方程式: 。
(4)①用石墨和铁作电极,在隔膜电解槽中电解A的溶液,阳极产生X2,电解A溶液的离子方程式为 。
②实验室常用含X元素的一种化合物E制取O2 ,工业上用无隔膜电解槽(石墨和铁作电极,温度为42~44 ℃)电解A的溶液生产化合物E。假设电解时电解槽进液口溶液中A 的浓度为2 mol?L-1,液口溶液中A的浓度为1.6 mol?L-1(进出口流量相同),则液口溶液中E的浓度为
mol?L-1。
