题目内容
17.下列关于有机物的说法不正确的是( )①CH3-CH═CH2和CH2═CH2的最简式相同
②CH≡CH和C6H6含碳量相同
③丁二烯和丁烯为同分异构体
④正戊烷、异戊烷、新戊烷的沸点逐渐变低
⑤标准状况下,11.2L的戊烷所含的分子数为0.5NA(NA为阿伏加德罗常数)
⑥能够快速、微量、精确地测定相对分子质量的物理方法是核磁共振谱法.
| A. | ①②⑥ | B. | ②③④ | C. | ②④⑥ | D. | ③⑤⑥ |
分析 ①根据最简原子个数比确定最简式;
②CH≡CH和C6H6:中C、H原子个数比均为1:1;
③丁二烯和丁烯分子中含有的碳碳双键数目不同;
④碳原子数目相同有机物,支链越多,沸点越低,则正戊烷、异戊烷、新戊烷的沸点逐渐变低;
⑤标准状况下,戊烷为液体,不能使用标况下的气体摩尔体积计算其物质的量.
⑥质谱法测物质的相对分子质量.
解答 解:①CH3-CH=CH2和CH2=CH2的最简式的是CH2,二者的最简式相同,故①正确;
②CH≡CH和C6H6的最简式的是CH,所以二者的含碳量相同,故②正确;
③丁二烯为二烯烃,丁烯为单烯烃,二者的结构不同,所以二者一定不属于同系物,故③错误;
④正戊烷、异戊烷、新戊烷分子中含有的碳原子数目,含有的支链逐渐增多,则它们的沸点逐渐变低,故④正确;
⑤标准状况下,戊烷的状态不是气体,题中条件无法计算11.2L的戊烷的物质的量,故⑤错误;
⑥测物质的相对分子质量的方法为质谱法,核磁共振氢谱用于测物质的结构,故⑥错误.
根据以上分析,正确的有:③⑤⑥,
故选D.
点评 本题考查了常见化学用语的判断,题目难度不大,注意掌握同系物、同分异构体、同位素、同素异形体的概念及判断方法,明确各概念的区别.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
7.下列有关对定量实验误差分析正确的是( )
| A. | 中和热测定实验中,缓慢地将NaOH溶液倒入测定装置中--测定结果无影响 | |
| B. | 酸碱中和滴定实验中,滴定前无气泡而滴定后有气泡_测定结果偏高 | |
| C. | 测定溶液pH的实验中,用干燥pH试纸测定新制氯水的pH--测定结果无影响 | |
| D. | 现需90mL 1.0mol•L-1NaOH溶液,称取3.6gNaOH固体配制--溶液浓度偏低 |
8.16O和18O是氧元素的两种核素,NA表示阿伏加德罗常数,下列说法正确的( )
| A. | 16O2与18O2互为同位素 | |
| B. | 16O与18O核外电子排布方式相同 | |
| C. | 通过化学变化可以实现16O与18O间的相互转化 | |
| D. | 1.12 L 16O2和1.12 L 18O2均含0.1NA个氧原子 |
5.低温脱硝技术可用于处理废气中的氮氧化物,发生的化学反应为:2NH3(g)+NO(g)+NO2(g)?2N2(g)+3H2O(g)△H<0 在恒容的密闭容器中,下列有关说法正确的是( )
| A. | 平衡时,其他条件不变,升高温度可使该反应的平衡常数增大 | |
| B. | 平衡时,其他条件不变,增加NH3的浓度,废气中氮氧化物的转化率减小 | |
| C. | 平衡时,2v正(NO)=v逆(N2) | |
| D. | 其他条件不变,使用高效催化剂,废气中氮氧化物的转化率增大 |
12.食醋是日常饮食中的一种调味剂,它对改善食物的口感,增进食欲,促进食物消化有独特的功能,因而深受人们青睐.国家标准规定,酿造的食醋中的醋酸含量不得低于3.5g/100mL.某校兴趣小组的同学到超市购买了
某品牌食醋,在实验室中进行食醋中醋酸含量的定量测定实验.
实验原理:用已知浓度的氢氧化钠溶液和醋酸反应.
(1)因食醋有颜色,可能干扰中和滴定时对指示剂颜色的观察,所以须先脱色,但又不能影响醋酸含量的测定,下列所加脱色剂适宜的是C
(填序号). A、氯水 B、Na2O2C、活性炭 D、SO2
(2)用酸式(填“酸式”或“碱式”)滴定管取步骤(1)所得的食醋20.00mL,加入到一洁净的锥形瓶中,并滴加2滴酚酞作指示剂.
(3)用0.5000mol•L-1氢氧化钠溶液进行滴定,并重复滴定操作两次.某同学的实验数据记录如下表:
(4)在实验步骤(2)中,加适量水稀释食醋,对实验结果有无影响?
无影响(填“有影响”或“无影响”),为什么?稀释过程中溶质物质的量不变,消耗的NaOH物质的量不变.
(5)老师在审核了这一表格后指出,所记录的数据有一明显失误,此失误是滴定管的读数在小数点后没有保留两位.实验操作中也存在着失误,在计算时应舍去这一组数据,这一组是第二次滴定的数据.
(6)请以表格中的数据通过计算后说明该食醋是否符合国家标准?不符合(填“符合”或“不符合”).
某品牌食醋,在实验室中进行食醋中醋酸含量的定量测定实验.
实验原理:用已知浓度的氢氧化钠溶液和醋酸反应.
(1)因食醋有颜色,可能干扰中和滴定时对指示剂颜色的观察,所以须先脱色,但又不能影响醋酸含量的测定,下列所加脱色剂适宜的是C
(填序号). A、氯水 B、Na2O2C、活性炭 D、SO2
(2)用酸式(填“酸式”或“碱式”)滴定管取步骤(1)所得的食醋20.00mL,加入到一洁净的锥形瓶中,并滴加2滴酚酞作指示剂.
(3)用0.5000mol•L-1氢氧化钠溶液进行滴定,并重复滴定操作两次.某同学的实验数据记录如下表:
| 食醋的体积/mL | 所用氢氧化钠溶液的体积/mL | |
| 第一次 | 20.00 | 19.8 |
| 第二次 | 20.00 | 21.2 |
| 第三次 | 20.00 | 19.7 |
无影响(填“有影响”或“无影响”),为什么?稀释过程中溶质物质的量不变,消耗的NaOH物质的量不变.
(5)老师在审核了这一表格后指出,所记录的数据有一明显失误,此失误是滴定管的读数在小数点后没有保留两位.实验操作中也存在着失误,在计算时应舍去这一组数据,这一组是第二次滴定的数据.
(6)请以表格中的数据通过计算后说明该食醋是否符合国家标准?不符合(填“符合”或“不符合”).
2.下列关于热化学反应的描述中正确的是( )
| A. | 已知H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ/mol,则H2SO4和Ba(OH)2反应的反应热△H=2×(-57.3)kJ/mol | |
| B. | 燃料电池中将甲醇蒸气转化为氢气的热化学方程式是CH3OH(g)+$\frac{1}{2}$O2(g)═CO2(g)+2H2 (g)△H=-192.9 kJ/mol,则CH3OH(g)的燃烧热△H=-192.9 kJ/mol | |
| C. | H2(g)的燃烧热△H=-285.8 kJ/mol,则2H2O(g)═2H2(g)+O2(g)△H=+571.6 kJ/mol | |
| D. | 葡萄糖的燃烧热△H=-2800 kJ/mol,则 $\frac{1}{2}$C6H12O6(s)+3O2(g)═3CO2(g)+3H2O(l)△H=-1400 kJ/mol |
9.a mol FeS与b mol FeO投入到V L、c mol•L-1的硝酸溶液中充分反应,产生NO气体,所得澄清溶液成分可看做是Fe(NO3)3、H2SO4的混合液,则反应中未被还原的硝酸可能为( )
①(a+b)×63g ②(a+b)×189g ③3(a+b) mol ④(Vc-$\frac{9a+b}{3}$)mol.
①(a+b)×63g ②(a+b)×189g ③3(a+b) mol ④(Vc-$\frac{9a+b}{3}$)mol.
| A. | ②④ | B. | ②③④ | C. | ②③ | D. | ①②③④ |
6.使1mol乙烯与氯气发生完全加成反应,然后使该加成反应的产物与氯气在光照的条件下发生完全取代反应,则两个过程中消耗的氯气的总的物质的量是( )
| A. | 5mol | B. | 4.5mol | C. | 5.5mol | D. | 6mol |
7.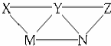 KHSO4、BaCl2、Na2CO3、FeSO4和氯水五种溶液,有如图所示的相互反应,图中每条连线两端的物质可以发生化学反应.下列说法不合理的是( )
KHSO4、BaCl2、Na2CO3、FeSO4和氯水五种溶液,有如图所示的相互反应,图中每条连线两端的物质可以发生化学反应.下列说法不合理的是( )
 KHSO4、BaCl2、Na2CO3、FeSO4和氯水五种溶液,有如图所示的相互反应,图中每条连线两端的物质可以发生化学反应.下列说法不合理的是( )
KHSO4、BaCl2、Na2CO3、FeSO4和氯水五种溶液,有如图所示的相互反应,图中每条连线两端的物质可以发生化学反应.下列说法不合理的是( )| A. | X可能为KHSO4 | B. | M不可能是BaCl2 | C. | Y一定为Na2CO3 | D. | N可能是FeSO4 |