题目内容
20.在25℃时,某溶液中由水电离出的c(H+)=10-12mol•L-1.该溶液的pH可能为( )| A. | 12 | B. | 7 | C. | 6 | D. | 4 |
分析 在25℃时,某溶液中由水电离出的c(H+)水=1.0×10-12 mol/L<10-7mol/L,说明该溶液中的溶质抑制水的电离,溶质能电离出氢离子、氢氧根离子就能抑制水电离,据此分析判断.
解答 解:25℃时Kw=c(OH-)×c(H+)=10-14,纯水中c(H+)=c(OH-)=1.0×10-7 mol/L,在25℃时,某溶液中由水电离出的c(H+)水=1.0×10-12 mol/L<10-7mol/L,说明该溶液中的溶质抑制水的电离,则溶质能电离出氢离子、氢氧根离子,该溶质可能是酸或碱,
若为酸溶液,溶液中氢氧根离子是水电离的,则溶液中氢离子浓度为:c(H+)=$\frac{1×1{0}^{-14}}{1×1{0}^{-12}}$=10-2mol•L-1,该溶液的pH=2;
若为碱溶液,溶液中氢离子是水的电离的,则溶液中的c(H+)=10-12mol•L-1,该溶液的pH=12,
故选A.
点评 本题考查了溶液pH的计算、水的电离及其影响,题目难度不大,明确酸碱盐对水的电离的影响为解答关键,注意掌握溶液酸碱性与溶液pH的关系,试题培养了学生的分析、理解能力及灵活应用能力.

练习册系列答案
相关题目
10.下列都属于二次能源的是( )
| A. | 电能、蒸汽 | B. | 氢能、风能 | C. | 原煤、石油 | D. | 地热能、潮汐能 |
11.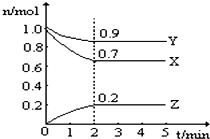 某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:
某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:
(1)该反应的化学方程式为3X+Y?2Z
(2)从开始至2min,Z的平均反应速率为0.05mol/(L•min)
(3)某探究性学习小组用相同质量的锌和相同浓度的足量的稀盐酸反应得到实验数据如下表所示:
①该实验的目的是探究固体表面积、温度对锌和稀盐酸反应速率的影响;
②实验Ⅰ和Ⅱ表明温度越高,化学反应速率越大;
③能表明固体的表面积对反应速率有影响的实验编号是Ⅱ和Ⅲ;
④请设计一个实验方案证明盐酸的浓度对该反应的速率的影响:在相同的温度下,采用相同状态的质量相同的锌片与两种体积相同但浓度不同的盐酸反应.
 某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:
某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:(1)该反应的化学方程式为3X+Y?2Z
(2)从开始至2min,Z的平均反应速率为0.05mol/(L•min)
(3)某探究性学习小组用相同质量的锌和相同浓度的足量的稀盐酸反应得到实验数据如下表所示:
| 实验编号 | 锌的状态 | 反应温度/℃ | 收集100mL氢气 所需时间/s |
| Ⅰ | 薄片 | 15 | 200 |
| Ⅱ | 薄片 | 25 | 90 |
| Ⅲ | 粉末 | 25 | 10 |
②实验Ⅰ和Ⅱ表明温度越高,化学反应速率越大;
③能表明固体的表面积对反应速率有影响的实验编号是Ⅱ和Ⅲ;
④请设计一个实验方案证明盐酸的浓度对该反应的速率的影响:在相同的温度下,采用相同状态的质量相同的锌片与两种体积相同但浓度不同的盐酸反应.
8.下列物质中,易溶于水的是( )
| A. | KNO3 | B. | BaCO3 | C. | AgCl | D. | CuO |
5.关于3mol NO,下列说法正确的是( )
| A. | 质量为30 g | |
| B. | 含有6.02×1023个NO子 | |
| C. | 标准状况下的体积为67.2L | |
| D. | 与足量氧气完全反应,生成6mol NO2 |
3.下列说法正确的是( )
| A. | 分子组成相差一个或几个“-CH2-”原子团的物质互为同系物,它们有相似的化学性质和不同的物理性质 | |
| B. | 甲烷是烷烃中碳的含量最低的,也是最简单的烃 | |
| C. | 不带支链的烃,其分子都是直线型的 | |
| D. | 常温时烷烃的同系物,只有四种呈气态 |