题目内容
下列说法正确的是
| A.pH=7的溶液一定是中性溶液 |
| B.能自发进行的化学反应,不一定是△H<0、△S>0 |
| C.吸热反应发生过程中要不断从外界获得能量,放热反应一定不需要吸收外界能量 |
| D.Ksp不仅与难溶电解质的性质和温度有关,而且与溶液中的离子浓度有关 |
B
A不正确,因为没有指明温度。反应是放热反应还是吸热反应,与反应条件无关,C不正确。D不正确,Ksp仅与难溶电解质的性质和温度有关。根据△G=△H-T·△S可知,选项B正确。答案选B。

练习册系列答案
相关题目
 2CH3OH(g) △H= 37Kj·mol-1
2CH3OH(g) △H= 37Kj·mol-1 CH3OH(g) △H <0。现将l0mol CO与20mol H2置于密闭容器中,在催化剂作用下发生反应生成甲醇,CO的平衡转化率(
CH3OH(g) △H <0。现将l0mol CO与20mol H2置于密闭容器中,在催化剂作用下发生反应生成甲醇,CO的平衡转化率(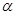 )与温度、压强的关系如下图所示。
)与温度、压强的关系如下图所示。
 =4时,CO2的转化率随时间的变化关系如右图所示。
=4时,CO2的转化率随时间的变化关系如右图所示。

 2NH3(g)+CO2(g)
2NH3(g)+CO2(g)
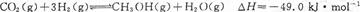
 CH3CH2OH(g)+3H2O(g),则可推测该反应是吸热反应
CH3CH2OH(g)+3H2O(g),则可推测该反应是吸热反应 
 CH3OH(g) ΔH1
CH3OH(g) ΔH1