题目内容
【题目】氮及其化合物在生产生活中应用广泛。回答下列问题:
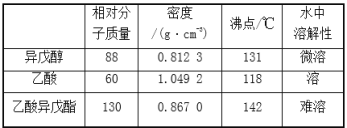
(1)“中国制造2025”是中国政府实施制造强国战略第一个十年行动纲领。氮化铬(CrN)具有极高的硬度和力学强度、优异的抗腐蚀性能和高温稳定性能,氮化铬在现代工业中发挥更重要的作用,请写出Cr3+的外围电子排布式___;基态铬、氮原子的核外未成对电子数之比为___。
(2)过硫酸铵[(NH4)2S2O8],广泛地用于蓄电池工业、石油开采、淀粉加工、油脂工业、照相工业等,过硫酸铵中N、S、O的第一电离能由大到小的顺序为___,过硫酸铵的阳离子的空间构型为___。
(3)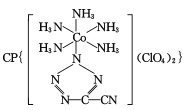 是20世纪80年代美国研制的典型钝感起爆药Ⅲ,它是由
是20世纪80年代美国研制的典型钝感起爆药Ⅲ,它是由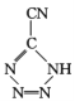 和[Co(NH3)5H2O](ClO4)3反应合成的,
和[Co(NH3)5H2O](ClO4)3反应合成的,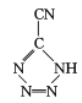 中孤电子对与π键比值为__,CP的中心Co3+的配位数为___。
中孤电子对与π键比值为__,CP的中心Co3+的配位数为___。
【答案】3d3 2:1 N>O>S 正四面体 5:4 6
【解析】
写出Cr的电子排布式、Cr和N的价电子轨道表示式,可确定Cr3+的电子排布式及未成对电子数;总的来说,元素的第一电离能与非金属性成正比,只有价电子所在轨道半满、全满或全空时出现反常;在![]() 中,中心N原子的价层电子对数为4,由此可确定其空间构型;在化合物分子中,形成共价键的原子间一定形成σ键,除σ键之外的共价键为π键;配合物中,中心离子的配位数等于配体与中心离子形成的配位键的数目。
中,中心N原子的价层电子对数为4,由此可确定其空间构型;在化合物分子中,形成共价键的原子间一定形成σ键,除σ键之外的共价键为π键;配合物中,中心离子的配位数等于配体与中心离子形成的配位键的数目。
(1)Cr的外围电子排布式为3d54s1,则Cr3+的外围电子排布式为3d3;基态铬、氮原子的核外价电子轨道表示式分别为![]() 、
、![]() ,未成对电子数之比为6:3=2:1;答案为:3d3;2:1;
,未成对电子数之比为6:3=2:1;答案为:3d3;2:1;
(2) N、S、O的非金属性O>N>S,但由于N原子的价电子处于半满状态,电子的能量低,第一电离能出现反常,所以第一电离能由大到小的顺序为N>O>S,过硫酸铵的阳离子为![]() ,中心N原子的价层电子对数为4,所以空间构型为正四面体;答案为:N>O>S;正四面体;
,中心N原子的价层电子对数为4,所以空间构型为正四面体;答案为:N>O>S;正四面体;
(3) 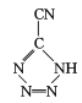 中,5个N原子含有5个孤对电子,N=C、N=N、C≡N键中分别含有1个、1个、2个π键,孤电子对与π键比值为5:4,CP的中心Co3+与配体中的N原子共形成6个配位键,所以配位数为6;答案为:5:4;6。
中,5个N原子含有5个孤对电子,N=C、N=N、C≡N键中分别含有1个、1个、2个π键,孤电子对与π键比值为5:4,CP的中心Co3+与配体中的N原子共形成6个配位键,所以配位数为6;答案为:5:4;6。

 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案【题目】(1)如图是部分元素原子的第一电离能I1随原子序数变化的曲线图(其中12号至17号元素的有关数据缺失)。
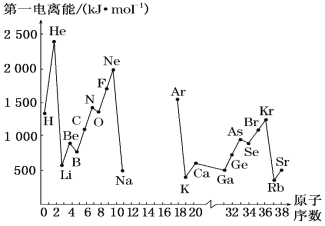
①认真分析图中同周期元素第一电离能的变化规律,推断Na~Ar元素中,Al的第一电离能的大小范围在哪两种元素之间为_____(填元素符号);
②图中第一电离能最小的元素在周期表中的位置是___________。
(2)已知元素的电负性和元素的化合价一样,也是元素的一种基本性质。下面给出14种元素的电负性:
元素 | Al | B | Be | C | Cl | F | Li |
电负性 | 1.5 | 2.0 | 1.5 | 2.5 | 3.0 | 4.0 | 1.0 |
元素 | Mg | N | Na | O | P | S | Si |
电负性 | 3.0 | 0.9 | 3.5 | 2.1 | 2.5 | 1.8 |
已知:两成键元素间电负性差值大于1.7时,形成离子键,两成键元素间电负性差值小于1.7时,形成共价键。
①通过分析电负性值变化规律,确定Mg元素电负性值的最小范围________;
②判断下列物质是离子化合物还是共价化合物:
A.Li3N
Ⅰ.属于离子化合物的是_____;Ⅱ.属于共价化合物的是____;请设计一个实验方案证明上述所得到的结论____