题目内容
如图23所示测定Na2O2(含Na2O杂质)纯度的实验装置,不同时间电子天平的读数如列表所示:
试计算样品中的质量分数,并估算最后溶液的pH。?
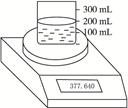
图2-3
| 实验操作 | 时间/s | 电子天平读数/g |
| 烧杯+水 | | 370.000 |
| 烧杯+水+样品 | 0 | 377.640 |
| 30 | 376.920 | |
| 60 | 376.400 | |
| 90 | 376.200 | |
| 120 | 376.200 |

图2-3
w (Na2O2)=91.9% pH=14
由表中数据可知,所取样品的质量为377.640 g-370.000 g="7.640" g,样品投入水中,放出氧气,随着反应的进行,电子天平的读数逐渐减少,至90 s开始读数不变,说明此时过氧化钠已反应完全,此时的质量减少量即为反应生成的氧气的质量377.640 g-376.200 g="1.440" g。设样品中Na2O2的质量为x,生成的NaOH的物质的量为y,则有
2Na2O2+2H2O 4NaOH+O2↑?
4NaOH+O2↑?
156g 4 mol 32g
x?? y? 1.440g
x= ="7.020" g?
="7.020" g?
y= ="0.180" mol?
="0.180" mol?
w(Na2O2)= ×100%=91.9%
×100%=91.9%
m(Na2O)="7.640" g-7.020 g="0.62" g?
设与水反应生成的NaOH的物质的量为z,则有?
Na2O+H2O 2NaOH?
2NaOH?
62 g 2 mol?
0.62 g z?
z= ="0.02" mol?
="0.02" mol?
c(OH-)=c(NaOH)= ="1" mol·L-1?
="1" mol·L-1?
c(H+)=10-14mol·L-1pH=14。
2Na2O2+2H2O
 4NaOH+O2↑?
4NaOH+O2↑?156g 4 mol 32g
x?? y? 1.440g
x=
 ="7.020" g?
="7.020" g?y=
 ="0.180" mol?
="0.180" mol?w(Na2O2)=
 ×100%=91.9%
×100%=91.9%m(Na2O)="7.640" g-7.020 g="0.62" g?
设与水反应生成的NaOH的物质的量为z,则有?
Na2O+H2O
 2NaOH?
2NaOH?62 g 2 mol?
0.62 g z?
z=
 ="0.02" mol?
="0.02" mol?c(OH-)=c(NaOH)=
 ="1" mol·L-1?
="1" mol·L-1?c(H+)=10-14mol·L-1pH=14。

练习册系列答案
 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案
相关题目
