题目内容
14.实验室准备较快地制取氢气,可采用的方法是( )| A. | 用纯锌与稀硫酸反应 | |
| B. | 用粗锌与稀硫酸反应 | |
| C. | 用粗锌与稀硝酸反应 | |
| D. | 在CuSO4溶液中浸泡过的纯锌与稀硫酸反应 |
分析 实验室制备氢气,通常用活泼金属锌与稀硫酸反应,为加快反应速率,通常用粗锌.
解答 解:稀硝酸和锌反应生成NO,不能用稀硝酸,
纯锌和粗锌相比较,粗锌形成原电池反应较快,
故选B.
点评 本题考查气体的制备,题目难度不大,本题注意制备气体时,要保证气体纯净、反应速率较大、易操作.

练习册系列答案
 教材全解字词句篇系列答案
教材全解字词句篇系列答案
相关题目
4.A、B均为短周期主族元素,A原子的最外层有2个电子,B原子的最外层有7个电子,这两种元素形成化合物的化学式是( )
| A. | AB2 | B. | A2B | C. | AB | D. | A2B3 |
5.如图表示4-溴环已烯所发生的4个不同反应,其中,有机产物含有两种官能团的反应是( )

| A. | ①④ | B. | ②③ | C. | ①② | D. | ③④ |
19.下列溶液中,溶质的物质的量浓度为1mol/L的是( )
| A. | 将40 g NaOH溶于1 L水所得的溶液 | |
| B. | 将80 g SO3溶于水并配成1 L的溶液 | |
| C. | 将0.5 mol/L的NaNO3溶液100 mL加热蒸发掉50 g水的溶液 | |
| D. | 含K+为2 mol的K2SO4溶液 |
3.某溶液中可能含有:Na+、Mg2+、Fe2+、Fe3+、I-、Cl-、NO3-、CO32-、SO42-中的几种(不考虑水的电离和离子的水解因素),各离子浓度均0.1mol•L-1.往该溶液中加入过量稀盐酸,溶液颜色变深且阴离子种类不变,下列说法不正确的是( )
| A. | 溶液颜色变深可能是Fe2+或I-被氧化 | |
| B. | 原溶液中肯定含有Fe2+、Cl-、NO3-,肯定不含有Na+、Fe3+、I-、CO32- | |
| C. | 取少量原溶液,加入盐酸酸化的BaCl2溶液,若有白色沉淀产生,则原溶液中含有Mg2+ | |
| D. | 该溶液中是否存在Na+,无需通过焰色反应确定 |
4.下列化学实验事实及其解释都正确的是( )
| A. | 向KMnO4溶液中滴加盐酸,KMnO4溶液的氧化能力增强,说明Mn元素化合价升高了 | |
| B. | 向AlCl3稀溶液中加入足量NaOH固体,振荡,溶液仍为澄清,说明c(Al3+)没有变 | |
| C. | 向CuSO4溶液中通入过量的NH3,溶液变为深蓝色,说明c(Cu2+)增大了 | |
| D. | 将少量CaCl2溶液中滴入含酚酞的Na2CO3溶液中,红色变浅,说明c(OH-)减小了 |
 (1)在一定条件下,对于密闭容器中进行的可逆反应:2HI (g)?H2(g)+I2(g),下列说法中,能说明这一反应已经达到化学反应限度的是D
(1)在一定条件下,对于密闭容器中进行的可逆反应:2HI (g)?H2(g)+I2(g),下列说法中,能说明这一反应已经达到化学反应限度的是D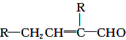 水杨酸酯E为紫外线吸收剂,可用于配制防晒霜.E的一种合成路线如下:
水杨酸酯E为紫外线吸收剂,可用于配制防晒霜.E的一种合成路线如下: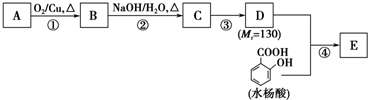
 .
.