题目内容
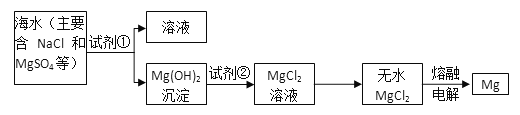
【题目】利用海水可以提取氯化钠、溴、碘等产品。海带提碘的流程如下:
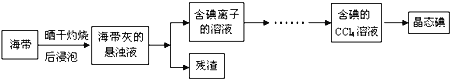
(1)CCl4含有___________键的______________分子(均选填“极性”或“非极性”)。
(2)灼烧海带时除需要三脚架、酒精灯、泥三角外,还需要的主要仪器是____________。
(3)为更好的完成实验,灼烧海带时,需加入一定量的氢氧化钠充分混合后再灼烧。此操作目的是___________________________________。
(4)向盛有碘离子溶液中加入CCl4和氯水,______(填:“上”或“下”)层呈紫红色;如果氯水加过量,CCl4层会由紫红色变成无色。整个过程中被氧化的微粒是__________________。写出并配平CCl4层由紫红色变成无色的化学反应方程式:__________
![]()
【答案】 极性 非极性 坩埚、玻璃棒 坩埚钳 (写对两个即可) 灼烧时碘离子易被空气中氧气氧化成为I2而挥发,有氢氧化钠时I2会转化成为无机盐,能减少碘的挥发 下 I2、I- I2+5Cl2+6 H2O→2HIO3+10HCl
【解析】(1)四氯化碳是空间正四面体,为非极性分子,共价键为极性键;(2)灼烧固体物质一般使用(瓷)坩埚,而坩埚加热需要用泥三角支撑,然后放在三脚架上,三脚架下面的空间放酒精灯,加热时用玻璃棒搅拌,取用坩埚用坩埚钳,灼烧海带时除需要三脚架、酒精灯、泥三角外,还需要的主要仪器是坩埚、玻璃棒、坩埚钳;(3)碘易与NaOH溶液反应,可加入一定量的氢氧化钠充分混合后再灼烧,有氢氧化钠时I2会转化成为无机盐,可减少碘的损失;(4)氯气氧化碘离子为碘单质,碘单质易溶于四氯化碳,四氯化碳不溶于水比水重,分层后在下层,向盛有碘离子溶液中加入CCl4和氯水,下层呈紫红色,如果氯水加过量,CCl4层会由紫红色变成无色是氯气氧化碘单质为碘酸,整个过程中被氧化的微粒是I2、I-,氯气氧化碘单质生成碘酸,本身被还原为氯化氢,反应的化学方程式为:I2+5Cl2+6H2O=2HIO3+10HCl。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案