题目内容
下列装置或操作能达到实验目的是( )
A、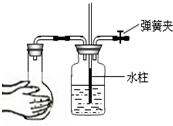 装置可用于检查气密性 |
B、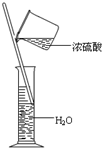 装置可用来配制稀硫酸 |
C、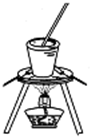 装置可用于实验室从食盐水中提取氯化钠 |
D、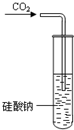 装置可用于证明酸性:H2CO3<H2SiO3 |
考点:化学实验方案的评价
专题:实验评价题
分析:A.装置气密性检查的原理一般是通过压强差来产生明显的现象来判断;
B.量筒不能用来稀释溶液;
C.蒸发溶液用蒸发皿;
D.根据溶液中发生的强酸制取弱酸的原理来分析.
B.量筒不能用来稀释溶液;
C.蒸发溶液用蒸发皿;
D.根据溶液中发生的强酸制取弱酸的原理来分析.
解答:
解:A.用手握住烧瓶使烧瓶内空气温度升高,体积增大,如果气密性好就可以在集气瓶中看到有长导管上升一段水柱.可以用来检查气密性,故A错误;
B.量筒一般用于量取液体,不能用作反应容器,不能用来稀释浓硫酸,故B错误;
C.蒸发溶液用蒸发皿,灼烧固体用坩埚,故C错误;
D.因往硅酸盐溶液通入二氧化碳,可以看到溶液变浑浊,是因为生成了难溶的硅酸沉淀,反应方程式是:Na2SiO3+H2O+CO2=Na2CO3+H2SiO3↓,反应原理是强酸制弱酸,说明碳酸比硅酸酸性强,故D正确.
故选D.
B.量筒一般用于量取液体,不能用作反应容器,不能用来稀释浓硫酸,故B错误;
C.蒸发溶液用蒸发皿,灼烧固体用坩埚,故C错误;
D.因往硅酸盐溶液通入二氧化碳,可以看到溶液变浑浊,是因为生成了难溶的硅酸沉淀,反应方程式是:Na2SiO3+H2O+CO2=Na2CO3+H2SiO3↓,反应原理是强酸制弱酸,说明碳酸比硅酸酸性强,故D正确.
故选D.
点评:本题考查化学实验方案的评价,为高频考点,涉及气密性检验、量取液体、蒸发液体和酸性比较等,把握实验操作的规范性、实验细节和实验原理为解答的关键,注意方案的合理性、评价性、操作性分析,题目难度不大.

练习册系列答案
相关题目
下列叙述中正确的是( )
| A、CO2分子内含有极性键,所以CO2分子是极性分子 |
| B、气态氢化物的稳定性:NH3>PH3>AsH3 |
| C、分子晶体、原子晶体中一定含有共价键,离子晶体一定含有离子键 |
| D、某非金属元素从游离态变成化合态时,该元素一定被还原 |
下列有关表达正确的是( )
A、热化学方程式C2H2(g)+
| ||
| B、H+(aq)+OH-(aq)=H2O(l);△H=-57.3 kJ/mol,表示含1molNaOH的氢氧化钠溶液与含0.5mol H2SO4的浓硫酸混合后放出57.3 kJ的热量 | ||
| C、少量的钠投入足量的水中:2Na+2H2O═2Na++2OH-+H2↑ | ||
| D、向明矾KAl(SO4)2溶液中滴入氢氧化钡溶液,至SO42-恰好沉淀完全:Al3++2SO42-+2Ba2++3OH-═2BaSO4↓+Al(OH)3↓ |
对于反应3Cl2+6NaOH
5NaCl+NaClO3+3H2O,以下叙述正确的是( )
| ||
| A、Cl2是氧化剂,NaOH是还原剂 |
| B、被氧化的氯原子和被还原的氯原子的物质的量之比为5:1 |
| C、NaCl是氧化产物 |
| D、氧化剂得电子数与还原剂失电子数之比为1:1 |
下列表达方式错误的是( )
A、甲烷的电子式 | ||
B、氟化钠的电子式 | ||
| C、硫离子的核外电子排布 1s22s22p4 | ||
D、碳-12原子
|
把0.02mol/L HAc溶液和0.01mol/L NaOH溶液等体积混合,则混合溶液中微粒浓度关系正确的是( )
| A、c(Ac-)>c(Na+) |
| B、c(HAc)>c(Ac-) |
| C、2c(H+)=c(Ac-)-c(HAc) |
| D、c(HAc)+c(Ac-)=0.01mol?L-1 |
下列关于摩尔质量的论述正确的是( )
| A、氢的摩尔质量是1g/mol |
| B、1个氮分子的摩尔质量为28g |
| C、水的摩尔质量为18g |
| D、NO3- 的摩尔质量为62g/mol |
