题目内容
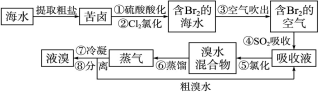
(14分) Mg(ClO3)2常用作催熟剂、除草剂等,下图为制备少量Mg(ClO3)2·6H2O的方法:

已知:1、卤块主要成分为MgCl2·6H2O,含有MgSO4、FeCl2等杂质。
2、几种化合物的溶解度(S)随温度(T)变化曲线如上图。
(1)加入BaCl2的目的是除_________,如何判断该离子已除尽_____________________。
(2)加入NaClO3饱和溶液会发生反应:MgCl2+2NaClO3==Mg(ClO3)2+2NaCl↓,请利用该反应,结合溶解度图,制取Mg(ClO3)2·6H2O的实验步骤依次为:
①取样,加入NaClO3饱和溶液充分反应;②蒸发浓缩;③ ;④冷却结晶;
⑤过滤、洗涤,获得Mg(ClO3)2·6H2O晶体。
产品中Mg(ClO3)2·6H2O含量的测定:
步骤1:准确称量3.50g产品溶解定容成100mL溶液。
步骤2:取10mL配好的溶液于锥形瓶中,加入10mL稀硫酸和20mL1.000mol/L的FeSO4溶液,微热。
步骤3:冷却至室温,用0.100mol/L K2Cr2O7溶液滴定至终点,此过程中反应的离子方程式为:
Cr2O72-+6Fe2++14H+==2Cr3++6Fe3++7H2O。
步骤4:将步骤2、3重复两次,平均消耗K2Cr2O7溶液15.00mL。
(3)写出步骤2中所发生反应的离子方程式 。
(4)步骤3中若滴定前用标准液润洗滴定管,会导致最终结果 (填“偏大”、“偏小”或“不变”)。
(5)产品中Mg(ClO3) 2·6H2O的质量分数为 (计算结果保留两位小数) 。
(14分)(1) SO42- (2分)
静置,取上层清液加入BaCl2,若无白色沉淀,则SO42-已沉淀完全(2分)
(2)趁热过滤 (2分)
(3)6H++ClO3-+6Fe2+==6Fe3++Cl-+3H2O (3分)
(4)不变 (2分)
(5) 78.31% (3分)
解析试题分析:(1)加入BaCl2的目的是除去SO42-,钡离子与硫酸根离子结合呈硫酸钡沉淀,过滤除去;检验SO42-是否除尽的方法是静置,取上层清液加入BaCl2,若无白色沉淀,则SO42-已沉淀完全;
(2)Mg(ClO3)2的溶解度受温度变化影响大,温度高时溶解度较大,温度低时溶解度较小,所以需要趁热过滤除去氯化钠;
(3)步骤2中所发生反应是ClO3-与Fe2+在酸性条件下的氧化还原反应,生成氯离子和铁离子、水,离子方程式为6H++ClO3-+6Fe2+==6Fe3++Cl-+3H2O;
(4)滴定管在加入标准液前必须用标准液润洗,所以最终结果不变;
(5)根据消耗K2Cr2O7溶液15.00mL可计算未被ClO3-氧化的亚铁离子的物质的量是0.015L×0.1mol/L×6=0.009mol,则被ClO3-氧化的亚铁离子的物质的量是0.02L×1mol/L-0.009mol=0.011mol,则100mL溶液中ClO3-的物质的量是0.011mol×1/6×10=0.11/6mol,则样品中Mg(ClO3) 2·6H2O的质量为0.11/6mol/2×299g/mol=2.741g,所以产品中Mg(ClO3) 2·6H2O的质量分数为2.741g/3.5g×100%=78.31%.
考点:考查物质的制备,离子的检验,实验步骤的判断,离子方程式的书写,氧化还原反应的计算,误差分析

 阅读快车系列答案
阅读快车系列答案为了除去括号中的杂质,采用的试剂和方法均为正确的是
| 选项 | 物质 | 加入试剂 | 方法 |
| A. | 甲苯(苯酚) | 浓溴水 | 过滤 |
| B. | NaOH(s)(少量NaCl) | 水 | 重结晶 |
| C. | 乙酸乙酯(乙酸) | 乙醇、H2SO4(浓) | 酯化 |
| D. | CO2(CO) | —— | 点燃 |
除去CO2中的HCl杂质最好是将混合气体通过足量的
| A.饱和NaOH溶液 | B.饱和NaHCO3溶液 |
| C.饱和Na2CO3溶液 | D.水 |
区别乙醇、苯和溴苯,最简单的方法是( )
| A.加酸性高锰酸钾溶液后振荡,静置 |
| B.与乙酸在有浓硫酸存在的条件下加热 |
| C.加蒸馏水后振荡,静置 |
| D.加硝酸银溶液后振荡,静置 |
甲酸钙广泛用于食品、化工、石油等工业生产上,300~400℃左右分解。Ⅰ、实验室制取的方法之一是:Ca(OH)2 +2HCHO + H2O2 = Ca(HCOO)2 + 2H2O + H2↑。
实验室制取时,将工业用氢氧化钙和甲醛依次加入到质量分数为30-70%的过氧化氢溶液中(投料物质的量之比依次为1∶2∶1.2),最终可得到质量分数98%以上且重金属含量极低的优质产品。
(1)过氧化氢比理论用量稍多,其目的是 。
(2)反应温度最好控制在30-70℃之间,温度不易过高,其主要原因是 。
(3)制备时在混合溶液中要加入微量硼酸钠抑制甲醛发生副反应外,还要加入少量的Na2S溶液,加硫化钠的目的是 。
(4)实验时需强力搅拌45min,其目的是 ;结束后需调节溶液的pH 7~8,其目的是 。最后经结晶分离、干燥得产品。
Ⅱ、某研究性学习小组用工业碳酸钙(主要成分为CaCO3;杂质为:Al2O3、FeCO3) 为原料,先制备无机钙盐,再与甲酸钠溶液混合制取甲酸钙。结合如图几种物质的溶解度曲线及表中相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算),现提供的试剂有:a.甲酸钠,b.5mol·L-1硝酸,c. 5mol·L-1盐酸,d. 5mol·L-1硫酸,e. 3%H2O2溶液,f.澄清石灰水。
请补充完整由碳酸钙制备甲酸钙的实验步骤
| 金属 离子 | 开始沉淀 的pH | 沉淀完全 的pH |
| Fe3+ | 1. 1 | 3. 2 |
| Al3+ | 3. 0 | 5. 0 |
| Fe2+ | 5. 8 | 8. 8 |
步骤1.称取13.6g甲酸钠溶于约20mL水,配成溶待用,并称取研细的碳酸钙样品10g待用。
步骤2. 。
步骤3. 。
步骤4.过滤后,将滤液与甲酸钠溶液混合,调整溶液pH 7~8,充分搅拌,所得溶液经蒸发浓缩、 、洗涤、60℃时干燥得甲酸钙晶体。
高锰酸钾是中学常用的试剂。工业上用软锰矿制备高锰酸钾流程如下。
(1)写出实验室利用KMnO4分解制取O2的化学方程式
(2)KMnO4稀溶液是一种常用的消毒剂。其消毒原理与下列物质相同的是
| A.84消毒液(NaClO溶液) |
| B.双氧水 |
| C.苯酚 |
| D.75%酒精 |
(4)写出反应①的化学方程式
(5)操作Ⅰ的名称是 ;操作Ⅱ根据KMnO4和K2CO3两物质在 (填
性质)上的差异,采用 (填操作步骤)、趁热过滤得到KMnO4粗晶体。
(6)上述流程中可以循环使用的物质有 、 (写化学式),鉴于此现用100吨软锰矿(含MnO287.0%),理论上可生产KMnO4晶体 吨(不考虑制备过程中原料的损失)。