题目内容
将10mL0.21mol?L-1的盐酸和10mL0.1mol?L-1 Ba(OH)2溶液混合,再用水稀释至5L,取出10mL滴入甲基橙试剂,则溶液显示的颜色是( )
| A、兰色 | B、红色 | C、黄色 | D、橙色 |
考点:酸碱混合时的定性判断及有关ph的计算
专题:电离平衡与溶液的pH专题
分析:常温下,将10mL0.21mol.L-1的HCl溶液n(H+)=0.01L×0.21mol/L=0.0021mol,10mL0.1mol.L-1的Ba(OH)2溶液n(OH-)=2×0.01L×0.1mol/L=0.002mol,酸过量,反应后溶液呈酸性,计算反应后c(H+),可计算pH,结合甲基橙变色范围分析判断,
解答:
解:常温下,将10mL0.21mol.L-1的HCl溶液n(H+)=0.01L×0.21mol/L=0.0021mol,10mL0.1mol.L-1的Ba(OH)2溶液n(OH-)=2×0.01L×0.1mol/L=0.002mol,酸过量,反应后溶液呈酸性,计算反应后c(H+)=
=2×10-5mol/L,可计算pH=5-lg2=5-0.301=4.7,甲基橙变色范围为3.1--4.4为橙色,所以取出10mL滴入甲基橙试剂,则溶液显示的颜色显黄色;
故选C.
| 0.0021mol-0.002mol |
| 5L |
故选C.
点评:本题考查有关混合物反应pH的简单计算,该题是高考中的常见题型,属于难度不大的试题,试题贴近高考,旨在培养学生分析、归纳和总结问题的能力,关键是注意酸碱物质的量的计算和过量问题,把握相关计算公式.

练习册系列答案
 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案
相关题目
以乙炔为原料制取CH2Br-CHBrCl,可行的反应途径是( )
| A、先与Cl2加成,再与Br2加成 |
| B、先与Cl2加成,再与HBr加成 |
| C、先与HCl加成,再与HBr加成 |
| D、先与HCl加成,再与Br2加成 |
下列图示与对应的叙述一定正确的是( )
A、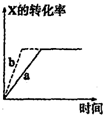 图所示反应:X(g)+Y(g)?2Z(g),b的压强一定比a大 |
B、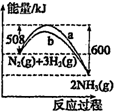 图表明合成氨反应是放热反应,b表示在反应体系中加入了催化剂 |
C、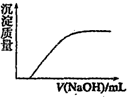 图表示向Ca(HCO3)2溶液中滴入NaOH溶液所得沉淀的质量变化 |
D、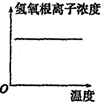 图表示明矾溶液受热时氢氧根浓度随温度的变化 |
用已准确称量过的氯化钠固体配制1.00mol/L的NaCl溶液0.5L,有下列仪器:①坩埚、②分液漏斗、③容量瓶、④烧瓶、⑤胶头滴管、⑥烧杯、⑦玻璃棒、⑧托盘天平,其中要用到的是( )
| A、③④⑤⑦ | B、①②⑤⑥⑧ |
| C、③⑤⑥⑦ | D、①③⑤⑥⑦ |
用NA表示阿伏加德罗常数的数值,下列叙述正确的是( )
| A、1 mol FeCl3与沸水反应生成胶体后,含有NA个Fe(OH)3胶粒 |
| B、25℃时,22.4 L甲烷含有的原子数为5NA |
| C、标准状况下,0.5NA个Cl2分子所占的体积为11.2 L |
| D、1.8 g重水(D2O)中含有的质子数为1.0NA |
蒸干下列溶液,能得到该溶质的是( )
| A、NaHCO3溶液 |
| B、KNO3溶液 |
| C、Fe2(SO4)3溶液 |
| D、AlCl3溶液 |
下列溶液分别加热蒸干,可得到该物质晶体的是( )
| A、FeCl3 |
| B、Cu(NO3)2 |
| C、Cu(HCO3)2 |
| D、Na2CO3 |
有机物A的结构简式为 ,它可通过不同的化学反应分别制得B、C、D和E四种物质.下列说法正确的是( )
,它可通过不同的化学反应分别制得B、C、D和E四种物质.下列说法正确的是( )

 ,它可通过不同的化学反应分别制得B、C、D和E四种物质.下列说法正确的是( )
,它可通过不同的化学反应分别制得B、C、D和E四种物质.下列说法正确的是( )
| A、A与E互为同分异构体 |
| B、C能使溴水褪色 |
| C、1 mol D与NaOH溶液反应,消耗NaOH的物质的量最多为3 mol |
| D、1 mol B最多能与5 mol H2发生加成反应 |
自来水可以用氯气消毒.某学生用这种自来水配制下列物质的溶液,不会产生明显药品变质的是( )
| A、NaOH |
| B、FeCl2 |
| C、NaHCO3 |
| D、FeCl3 |