题目内容
常温常压下,饱和氯水中氯气总浓度约为0.09mol/L,且存在可逆反应:Cl2+H2OHCl+HClO,实验测得约有三分之一的氯气与水发生了反应.反应Cl2+H2O?HCl+HClO的平衡常数为 .
考点:化学平衡常数的含义
专题:
分析:依据氯气与水反应:Cl2+H2O?HCl+HClO,该反应的平衡常数表达式为K=
,据此计算解答.
| c(H+)c(Cl-)c(HClO) |
| c(Cl2) |
解答:
解:饱和氯水中氯气总浓度约为0.09mol/L,则
Cl2+H2O?H++Cl-+HClO
起始浓度:0.09mol/L 0 0 0
转化浓度:0.03mol/L 0.03mol/L 0.03mol/L 0.03mol/L
平衡浓度:0.06mol/L 0.03mol/L 0.03mol/L 0.03mol/L
所以K=
=
=4.5×10-4;
故答案为:4.5×10-4.
Cl2+H2O?H++Cl-+HClO
起始浓度:0.09mol/L 0 0 0
转化浓度:0.03mol/L 0.03mol/L 0.03mol/L 0.03mol/L
平衡浓度:0.06mol/L 0.03mol/L 0.03mol/L 0.03mol/L
所以K=
| c(H+)c(Cl-)c(HClO) |
| c(Cl2) |
| 0.03×0.03×0.03 |
| 0.06 |
故答案为:4.5×10-4.
点评:本题考查了氯气的性质及化学平衡常数的计算,题目难度不大,解题时注意纯液体不能带入平衡常数表达式.

练习册系列答案
相关题目
某烷烃的结构简式为 ,它的正确命名是( )
,它的正确命名是( )
 ,它的正确命名是( )
,它的正确命名是( )| A、2-甲基-4-乙基戊烷 |
| B、4-甲基-2-乙基戊烷 |
| C、2,4-二甲基己烷 |
| D、3,5-二甲基己烷 |
下列叙述中,正确的是( )
①开发使用新型清洁能源,减少化石燃料的燃烧,可从防止酸雨的产生.
②我国从2000年起逐渐用二氧化氯代替氯气对饮用水进行消毒,因为二氧化氯杀菌、消毒能力强,功效长.
③氧化铝可用来制造耐火砖和坩埚等.
④Na2O2可用于呼吸面具中作为氧气的来源.
⑤建设三峡大坝使用大量水泥,水泥是硅酸盐材料.
⑥戴上浸有浓NaOH溶液的口罩,防止氯气中毒.
①开发使用新型清洁能源,减少化石燃料的燃烧,可从防止酸雨的产生.
②我国从2000年起逐渐用二氧化氯代替氯气对饮用水进行消毒,因为二氧化氯杀菌、消毒能力强,功效长.
③氧化铝可用来制造耐火砖和坩埚等.
④Na2O2可用于呼吸面具中作为氧气的来源.
⑤建设三峡大坝使用大量水泥,水泥是硅酸盐材料.
⑥戴上浸有浓NaOH溶液的口罩,防止氯气中毒.
| A、①④⑤ | B、①②④⑤ |
| C、除⑥外 | D、全部 |
下列关于化学平衡常数的说法中,正确的是( )
| A、化学平衡常数均无单位 |
| B、平衡常数越大则转化率越大 |
| C、对于一个化学计量数固定的反应,平衡常数的大小只与温度有关 |
| D、在平衡常数表达式中,反应物的浓度为初始浓度,生成物的浓度为平衡浓度 |
下列有关金属腐蚀与防护的说法不正确的是( )
| A、当镀锌铁制品的镀层破损时,镀层仍能对铁制品起保护作用 |
| B、当镀锡铁制品的镀层破损时,镀层仍能对铁制品起保护作用 |
| C、在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法 |
| D、可将地下输油钢管与外加直流电源的负极相连以保护它不受腐蚀 |
下列反应与Na2O2+SO2═Na2SO4相比较,Na2O2的作用相同的是( )
| A、2Na2O2+2CO2═2Na2CO3+O2↑ |
| B、2Na2O2+2SO3═2Na2SO4+O2↑ |
| C、Na2O2+H2SO4═Na2SO4+H2O2 |
| D、3Na2O2+Cr2O3═2Na2CrO4+Na2O |
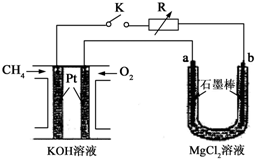 新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2,电解质为KOH溶液.某研究小组将甲烷燃料电池作为电源进行氯化镁溶液电解实验,电解装置如图所示.
新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2,电解质为KOH溶液.某研究小组将甲烷燃料电池作为电源进行氯化镁溶液电解实验,电解装置如图所示.