题目内容
写出下列物质的电子式
(1)NH3 ;
(2)MgCl2;
(3)KOH ;
(4)N2 .
(1)NH3
(2)MgCl2;
(3)KOH
(4)N2
考点:电子式
专题:化学键与晶体结构
分析:(1)氨气为共价化合物,分子中存在3对共用电子对,氮原子最外层达到8个电子,氢原子最外层达到2个电子;
(2)氯化镁为离子化合物,电子式需要标出阴阳离子所带电荷;
(3)氢氧化钾为离子化合物,电子式需要标出阴阳离子所带电荷;
(4)氮气中存在3对共用电子对,氮原子最外层达到8个电子;
(2)氯化镁为离子化合物,电子式需要标出阴阳离子所带电荷;
(3)氢氧化钾为离子化合物,电子式需要标出阴阳离子所带电荷;
(4)氮气中存在3对共用电子对,氮原子最外层达到8个电子;
解答:
解:(1)氨气为共价化合物,分子中存在3对共用电子对,氮原子最外层达到8个电子,氢原子最外层达到2个电子,氨气分子的电子式为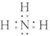 ;
;
故答案为: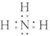 ;
;
(2)氯化镁为离子化合物,由镁离子和氯离子构成,氯化镁的电子式为: ,
,
故答案为: ;
;
(3)氢氧化钾为离子化合物,由钾离子和氢氧根离子构成,氢氧化钾的电子式为: ,
,
故答案为: ;
;
(4)氮气中存在氮氮三键,氮气的电子式为 ,
,
故答案为: ;
;
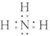 ;
;故答案为:
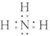 ;
;(2)氯化镁为离子化合物,由镁离子和氯离子构成,氯化镁的电子式为:
 ,
,故答案为:
 ;
;(3)氢氧化钾为离子化合物,由钾离子和氢氧根离子构成,氢氧化钾的电子式为:
 ,
,故答案为:
 ;
;(4)氮气中存在氮氮三键,氮气的电子式为
 ,
,故答案为:
 ;
;
点评:本题考查了电子式的书写,题目难度中等,注意掌握电子式的概念及书写原则,明确离子化合物与共价化合物的电子式表示方法及区别.

练习册系列答案
相关题目
下列说法中不正确的是( )
| A、能使澄清的石灰水变浑浊的气体可能是SO2 |
| B、能使品红溶液褪色将其煮沸溶液又变红的无色气体一定是SO2 |
| C、某强酸性溶液经分析其中含有大量的S2-,SO32- |
| D、用NaHSO3,Na2SO3与浓硫酸反应都可产生SO2 |
有德国重离子研究中心人工合成的第112号元素的正式名称为“Copernicium”,相应的元素符号位“Cn”.该元素的名称是为了纪念天文学家哥白尼而得名.该中心人工合成Cn的过程可表示为:
Zn+
Pb═
Cn+
n下列叙述中正确的是( )
70 30 |
208 82 |
277 112 |
1 0 |
| A、上述合成过程中属于化学变化 | ||
| B、Cn元素的相对原子质量为277 | ||
C、
| ||
| D、Cn元素位于元素周期表的第六周期,是副族元素 |
某一溴代烷水解后的产物在红热铜丝催化下,最多可被空气氧化生成2种不同的醛,该一溴代烷的分子式可能是( )
| A、C3H7Br |
| B、C4H9Br |
| C、C5H11Br |
| D、C6H13Br |
 二氧化氯泡腾片,有效成分(ClO2)是一种高效、安全的杀菌、消毒剂.
二氧化氯泡腾片,有效成分(ClO2)是一种高效、安全的杀菌、消毒剂.