题目内容
13.下列卤代烃在一定条件下能够发生消去反应的是( )| A. | CH3Br | B. |  | C. |  | D. |  |
分析 选项中均为卤代烃,与-X相连C的邻位C上有H可发生消去反应,以此来解答.
解答 解:A.与-Br相连的C没有邻位C,不能发生消去反应,故A不选;
B.与-Cl相连C的邻位C上没有H,不能发生消去反应,故B不选;
C.与-Cl相连C的邻位C上有H,能发生消去反应,故C选;
D.与-Br连C的邻位C上没有H,不能发生消去反应,故D不选;
故选C.
点评 本题考查有机物的结构与性质,为高频考点,把握卤代烃的性质、结构特点为解答的关键,侧重分析与应用能力的考查,注意消去反应的结构特点,题目难度不大.

练习册系列答案
相关题目
3. 已知:常温下,(1)Ka1(H2CO3)=4.3×10-7,Ka2(H2CO3)=5.6×10-11;(2)H2R及其钠盐的溶液中,H2R、HR-、R2-分别在三者中所占的物质的量分数(α)随溶液pH变化关系如图所示,下列叙述错误的是( )
已知:常温下,(1)Ka1(H2CO3)=4.3×10-7,Ka2(H2CO3)=5.6×10-11;(2)H2R及其钠盐的溶液中,H2R、HR-、R2-分别在三者中所占的物质的量分数(α)随溶液pH变化关系如图所示,下列叙述错误的是( )
 已知:常温下,(1)Ka1(H2CO3)=4.3×10-7,Ka2(H2CO3)=5.6×10-11;(2)H2R及其钠盐的溶液中,H2R、HR-、R2-分别在三者中所占的物质的量分数(α)随溶液pH变化关系如图所示,下列叙述错误的是( )
已知:常温下,(1)Ka1(H2CO3)=4.3×10-7,Ka2(H2CO3)=5.6×10-11;(2)H2R及其钠盐的溶液中,H2R、HR-、R2-分别在三者中所占的物质的量分数(α)随溶液pH变化关系如图所示,下列叙述错误的是( )| A. | 在pH=4.3的溶液中:3c(R2-)=c(Na+)+c(H+)-c(OH-) | |
| B. | 等体积等浓度的NaOH溶液与H2R溶液混合后,溶液中水的电离程度比纯水小 | |
| C. | 在pH=3的溶液中存在$\frac{c({R}^{2-})×c({H}_{2}R)}{c(H{R}^{-})}$=10-3 | |
| D. | 向Na2CO3溶液中加入少量H2R溶液,发生反应:CO32-+H2R=HCO3-+HR- |
4.下列说法不正确的是( )
| A. | 胶体和溶液的本质区别是分散质粒子直径的大小 | |
| B. | 电解质与非电解质的本质区别,是在水溶液或熔融状态下中能否电离 | |
| C. | 科学家波尔首先提出原子核外的电子是在一定轨道上运动 | |
| D. | 具有相同质子数的微粒,一定属于同一种元素 |
1.对于某些离子的检验及结论一定正确的是( )
| A. | 加入稀盐酸产生无色无味气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32-或HCO3-中的一种或两种 | |
| B. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- | |
| C. | 加入碳酸钠溶液产生白色沉淀,再加盐酸,白色沉淀消失,可能有Ba2+ | |
| D. | 加入硝酸银溶液有白色沉淀生成,则溶液中一定含有Cl- |
8.实验时,不慎把浓NaOH溶液洒在皮肤上,正确的处理方法是( )
| A. | 用水冲洗,再涂上硼酸溶液 | |
| B. | 用稀硫酸溶液中和,再用水冲洗 | |
| C. | 用布擦去NaOH后,用稀硫酸溶液冲洗 | |
| D. | 用布擦去硫酸后,用大量水冲洗,再用3%-5%的碳酸氢钠溶液冲洗 |
5.下列叙述正确的是( )
| A. | 离子化合物中只能含离子键 | B. | 共价化合物中可能含离子键 | ||
| C. | 共价键只存在于共价化合物中 | D. | 离子键只存在于离子化合物中 |
2.下列各组物质在变化时所克服的离子间的作用力属于同种类型的是( )
| A. | 金刚石和晶体硫熔融 | B. | 石墨和食盐熔化 | ||
| C. | 晶体碘和干冰的升华 | D. | 金属钠和硝酸钠的熔化 |
3.盐城作为沿海地区有着丰富的海水资源,海水中主要含有Na+、K+、Ca2+、Mg2+、Cl-、SO42-、Br-、CO32-、HCO3-等离子.合理利用资源和保护环境是我市可持续发展的重要保证.
(1)海水经过处理后可以得到无水氯化镁,无水氯化镁是工业制取镁的原料.试写出电解熔融氯化镁制取金属镁的化学反应方程式MgCl2 $\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑.
(2)某化工厂生产过程中会产生含有Cu2+和Pb2+的污水.排放前拟用沉淀法除去这两种离子,根据下列数据,你认为投入Na2S(选填“Na2S”或“NaOH”)效果更好.
(3)火力发电在我国的能源利用中占较大比重,但是排放出的SO2会造成一系列环境和生态问题.利用海水脱硫是一种有效的方法,其工艺流程如图所示:
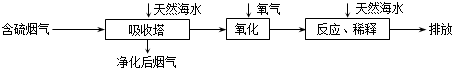
①天然海水的pH≈8,试用离子方程式解释天然海水呈弱碱性的原因CO32-+H2O?HCO3-+OH-或 HCO3-+H2O?H2CO3+OH-(任写一个).
②某研究小组为探究提高含硫烟气中SO2吸收效率的措施,进行了天然海水吸收含硫烟气的模拟实验,实验结果如图所示.
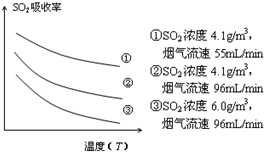
请你根据图示实验结果,就如何提高一定浓度含硫烟气中SO2的吸收效率,提出一条合理化建议:降低含硫烟气温度(或流速).
③天然海水吸收了含硫烟气后会溶有H2SO3、HSO3-等分子或离子,使用氧气将其氧化的化学原理是2H2SO3+O2=4H++2SO42-或2HSO3-+O2=2H++2SO42-(任写一个化学方程式或离子方程式).氧化后的“海水”需要引入大量的天然海水与之混合后才能排放,该操作的主要目的是中和、稀释经氧气氧化后海水中生成的酸(H+),减少污染.
(1)海水经过处理后可以得到无水氯化镁,无水氯化镁是工业制取镁的原料.试写出电解熔融氯化镁制取金属镁的化学反应方程式MgCl2 $\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑.
(2)某化工厂生产过程中会产生含有Cu2+和Pb2+的污水.排放前拟用沉淀法除去这两种离子,根据下列数据,你认为投入Na2S(选填“Na2S”或“NaOH”)效果更好.
| 难溶电解质 | Cu(OH)2 | CuS | Pb(OH)2 | PbS |
| Ksp | 4.8×10-20 | 6.3×10-36 | 1.2×10-15 | 1.0×10-28 |

①天然海水的pH≈8,试用离子方程式解释天然海水呈弱碱性的原因CO32-+H2O?HCO3-+OH-或 HCO3-+H2O?H2CO3+OH-(任写一个).
②某研究小组为探究提高含硫烟气中SO2吸收效率的措施,进行了天然海水吸收含硫烟气的模拟实验,实验结果如图所示.

请你根据图示实验结果,就如何提高一定浓度含硫烟气中SO2的吸收效率,提出一条合理化建议:降低含硫烟气温度(或流速).
③天然海水吸收了含硫烟气后会溶有H2SO3、HSO3-等分子或离子,使用氧气将其氧化的化学原理是2H2SO3+O2=4H++2SO42-或2HSO3-+O2=2H++2SO42-(任写一个化学方程式或离子方程式).氧化后的“海水”需要引入大量的天然海水与之混合后才能排放,该操作的主要目的是中和、稀释经氧气氧化后海水中生成的酸(H+),减少污染.