题目内容
如何利用
MgCl2溶液、AlCl3溶液、NaOH溶液和盐酸等设计实验,进行Mg(OH)2、Al(OH)3碱性强弱的对比性实验,来探究说明镁和铝两种元素原子失电子能力强弱?
答案:
解析:
解析:
|
答案:由所给的试剂可以分析设计,先用两支试管,分别取 MgCl2溶液、AlCl3溶液,再分别加入适量NaOH溶液,制得Mg(OH)2和Al(OH)3白色沉淀物,然后再将制得的氢氧化物分别分成两份,向一份中继续加入NaOH溶液,另一份加入盐酸.发现Mg(OH)2不溶于NaOH溶液只溶于盐酸;而Al(OH)3既能溶于NaOH溶液又能溶于盐酸,均变成无色透明的溶液.Mg(OH)2不溶于NaOH溶液只溶于盐酸,说明它只有碱的性质,没有酸的性质;而Al(OH)3溶于盐酸说明它具有碱的性质,又能溶于NaOH溶液,说明已经显示出酸的性质,说明它的碱性比Mg(OH)2的碱性弱.进而说明金属镁比铝失电子的能力强.思路:根据金属元素原子失电子能力强弱的判断方法,其中可以依据元素的最高价氧化物对应的水化物的碱性强弱来判断比较.但是,物质的碱性强弱又是通过什么方法来说明的呢?即必须知道碱性物质的碱性强弱的比较方法,依此再去设计实验进行比较说明.所以,此题需要先通过讨论或查阅资料等方式来解决这个前提条件. 资料在线 两性氢氧化物 不难知道,许多氢氧化物能和酸反应生成盐和水.我们把只和酸反应生成盐和水,而不能和碱反应生成盐和水的氢氧化物叫做碱;而把既能和酸反应生成盐和水,又能和碱反应生成盐和水的氢氧化物叫做两性氢氧化物.大量实验证明, Mg(OH)2是碱,而Al(OH)3是最常见的典型的两性氢氧化物,它和盐酸及氢氧化钠的反应方程式为Al(OH)3+3HCl Al(OH)3+NaOH Na[Al(OH)4]叫做四羟基合铝酸钠.其中,氢氧化物与碱反应生成了盐和水,说明氢氧化物已经显示出了一定的酸性. 对酸和碱的认识还有一种理论,称之为“酸碱电离理论”.首先,把电解质在水中电离时,能完全电离成离子,而在水中没有电解质分子存在的电解质,叫做强电解质,例如 NaOH、HCl、NaCl等强碱、强酸和大部分盐等,电离时用等号表示,如NaOHAl(OH)3 |

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
海洋中有丰富的食品、矿产、能源、药物和水产资源,下图为海水利用的部分过程.下列有关说法正确的是
( )
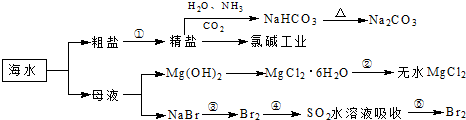
( )

| A、过程①中除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸 | B、用澄清的石灰水可鉴别NaHCO3和Na2CO3 | C、过程②中结晶出的MgCl2?6H2O要在HCl氛围中加热脱水制得无水MgCl2 | D、工业上通过电解饱和MgCl2溶液制取金属镁 |

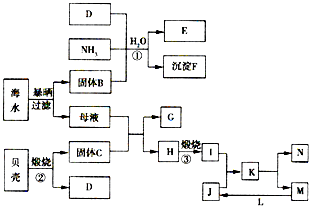 [化学与技术]海洋是巨大的资源宝库,从海洋中我们可以获得各种各样的化学物质,下图是综合利用海洋资源的一个例子(假设海水中存在的离子主要有Na+、Mg2+、Cl-).
[化学与技术]海洋是巨大的资源宝库,从海洋中我们可以获得各种各样的化学物质,下图是综合利用海洋资源的一个例子(假设海水中存在的离子主要有Na+、Mg2+、Cl-).