题目内容
(2012?宜春模拟)单质A与粉末化合物B组成的混合物相互转化关系如下图所示:
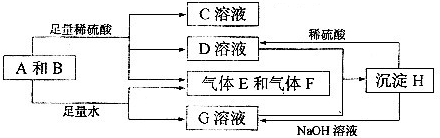
请回答下列问题:
(1)A单质的元素在周期表中处于
(2)D与G两溶液混合后发生反应的离子方程式为
(3)常温下,D溶液的pH
(4)用碳棒、稀硫酸、气体E和气体F组成燃料电池,该电池的正极反应式为

请回答下列问题:
(1)A单质的元素在周期表中处于
第三周期 IIIA族
第三周期 IIIA族
.(2)D与G两溶液混合后发生反应的离子方程式为
Al3++3AlO2-+6H2O=4Al(OH)3↓
Al3++3AlO2-+6H2O=4Al(OH)3↓
.(3)常温下,D溶液的pH
<
<
7(填“>”或“<”或”=”),其原因是Al3++3H2O  Al(OH)3+3H+
Al(OH)3+3H+
 Al(OH)3+3H+
Al(OH)3+3H+Al3++3H2O  Al(OH)3+3H+
Al(OH)3+3H+
(用离子方程式表示). Al(OH)3+3H+
Al(OH)3+3H+(4)用碳棒、稀硫酸、气体E和气体F组成燃料电池,该电池的正极反应式为
O2+4H++4e-=2H2O
O2+4H++4e-=2H2O
.分析:单质A与粉末化合物B组成的混合物与酸反应生成CD溶液和气体EF,单质A与粉末化合物B组成的混合物与足量水反应生成气体EF和G溶液;说明单质A和酸碱反应生成气体,判断A为Al;B为能与水反应生成生成碱和气体的物质,推断为Na2O2,转化关系中H可以和酸硫酸反应和碱氢氧化钠反应,说明H为两性物质判断为Al(OH)3;G为NaAlO2,D为Al2(SO4)3;C为Na2SO4,综合推断可知EF为氧气和氢气;依据判断出的物质回答问题.
解答:解:单质A与粉末化合物B组成的混合物与酸反应生成CD溶液和气体EF,单质A与粉末化合物B组成的混合物与足量水反应生成气体EF和G溶液;说明单质A和酸碱反应生成气体,判断A为Al;B为能与水反应生成生成碱和气体的物质,推断为Na2O2,转化关系中H可以和酸硫酸反应和碱氢氧化钠反应,说明H为两性物质判断为Al(OH)3;G为NaAlO2,D为Al2(SO4)3;C为Na2SO4,综合推断可知EF为氧气和氢气;
(1)A为铝周期表中在第三周期 IIIA族,故答案为:第三周期 IIIA族;
(2)D与G两溶液混合后发生反应是偏铝酸钠和硫酸铝混合发生双水解生成氢氧化铝沉淀,反应的离子方程式为:Al3++3AlO2-+6H2O=4Al(OH)3↓,
故答案为:Al3++3AlO2-+6H2O=4Al(OH)3↓;
(3)常温下,D溶液是硫酸铝溶液,铝离子水解显酸性,溶液的pH<7,原因是Al3++3H2O Al(OH)3+3H+,
Al(OH)3+3H+,
故答案为:<;Al3++3H2O Al(OH)3+3H+;
Al(OH)3+3H+;
(4)用碳棒、稀硫酸、气体E和气体F组成燃料电池是氢氧燃料电池,电解质是酸,原电池中 负极失电子发生氧化反应,正极上得到电子发生还原反应,所以该电池的正极是氧气得到电子发生还原反应,由于是酸性电池,所以电极反应式为:O2+4H++4e-=2H2O,故答案为:O2+4H++4e-=2H2O.
(1)A为铝周期表中在第三周期 IIIA族,故答案为:第三周期 IIIA族;
(2)D与G两溶液混合后发生反应是偏铝酸钠和硫酸铝混合发生双水解生成氢氧化铝沉淀,反应的离子方程式为:Al3++3AlO2-+6H2O=4Al(OH)3↓,
故答案为:Al3++3AlO2-+6H2O=4Al(OH)3↓;
(3)常温下,D溶液是硫酸铝溶液,铝离子水解显酸性,溶液的pH<7,原因是Al3++3H2O
 Al(OH)3+3H+,
Al(OH)3+3H+,故答案为:<;Al3++3H2O
 Al(OH)3+3H+;
Al(OH)3+3H+;(4)用碳棒、稀硫酸、气体E和气体F组成燃料电池是氢氧燃料电池,电解质是酸,原电池中 负极失电子发生氧化反应,正极上得到电子发生还原反应,所以该电池的正极是氧气得到电子发生还原反应,由于是酸性电池,所以电极反应式为:O2+4H++4e-=2H2O,故答案为:O2+4H++4e-=2H2O.
点评:本题考查了物质转化关系的判断应用,物质性质的分析应用,主要考查铝及其化合物性质的应用,水解反应应用,离子方程式的书写原则,原电池的原理应用和电极书写.

练习册系列答案
相关题目