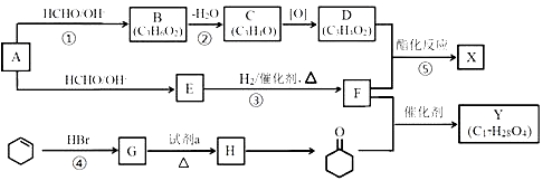
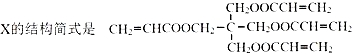题目内容
【题目】A、B、C、D、E、F、G、I均为前四周期原子序数依次增大的元素。A原子的L电子层的p能级上有一个空轨道;C的最外层有6个运动状态不同电子;D的基态原子外围电子排布式为3S2;E与D同周期,且在该周期中电负性最大;F、G是同族且原子序数差2的元素;I的基态原子外围只有一个单电子。
(1) 下列关于A2H4分子和H2C2分子的说法正确的是 。
A.分子中都含有σ键和π键 B.中心原子都sp2杂化
C.都是含极性键和非极性键的非极性分子
D.互为等电子体 E.A2H4分子的沸点明显低于H2C2分子
(2)A、B、C三种元素中的两种,能形成原子个数比为l:3的常见微粒,推测这两种微粒的空间构型为 。
(3)E能形成多种含氧酸,如HEO3、HEO2,请简述酸性HEO3大于HEO2的原因: 。
(4) G与AC能形成挥发性液体G(AC)4,则其固体属于 晶体。
(5) F常见晶体结构为体心立方堆积,原子半径为a nm,I常见晶体结构为面心立方堆积,原子半径为b nm,则两种金属的密度比为 (用含a、b的算式表示)。
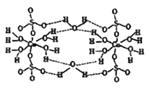
(6) 已知Ti3+可形成配位数为6,颜色不同的两种配合物晶体,一种为紫色,另一种为绿色。两种晶体的组成皆为TiCl3·6H2O。为测定这两种晶体的化学式,设计了如下实验:
a.分别取等质量的两种配合物晶体的样品配成待测溶液;
b.分别往待测溶液中滴入AgNO3溶液,均产生白色沉淀;
c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量,发现原绿色晶体的水溶液得到的白色沉淀质量为原紫色晶体的水溶液得到的沉淀质量的2/3。则绿色晶体配合物的化学式为________________,由Cl-所形成的化学键类型是________。
【答案】(1)E
(2)平面三角形
(3)HClO3中非羟基氧多,Cl正电性高,导致羟基中O的电子向Cl偏移,在水分子的作用下越易电离出H+,酸性越强。
(4)分子
(5)![]() 3
3
(6)[TiCl(H2O)5]Cl2·H2O 离子键、配位键(或共价键)
【解析】试题分析:A、B、C、D、E、F、G、I均为前四周期原子序数依次增大的元素。A原子的L电子层的p能级上有一个空轨道,则A可能是C或F;C的最外层有6个运动状态不同电子,所以C是O,则A是C,B是N;D的基态原子外围电子排布式为3S2,因此D是Mg;E与D同周期,且在该周期中电负性最大,则E是Cl;F、G是同族且原子序数差2的元素,因此二者是第Ⅷ族的Fe和Ni;I的基态原子外围只有一个单电子,原子序数最大,因此I是Cu。
(1) A2H4分子和H2C2分子分别是乙烯和双氧水,则A.双氧水分子中均是单键,只有σ键,没有π键,A错误;B.乙烯分子中中心原子碳原子为sp2杂化,双氧水分子中氧原子是sp3杂化,B错误;C.双氧水是极性分子,C错误;D.原子数和价电子数分别都相等的是等电子体,二者不能互为等电子体,D错误;E.双氧水分子间存在氢键,因此乙烯分子的沸点明显低于双氧水分子的,E正确,答案选E。
(2)C、N、O三种元素中的两种,能形成原子个数比为l:3的常见微粒,该微粒是碳酸根或硝酸根,中心原子的价层电子对数均是3,且不含孤对电子,所以这两种微粒的空间构型均为平面三角形。
(3)由于HClO3中非羟基氧多,Cl正电性高,导致羟基中O的电子向Cl偏移,在水分子的作用下越易电离出H+,因而酸性越强。
(4)G与AC能形成挥发性液体Ni(CO)4,这说明熔沸点较低,因此则其固体属于分子晶体。
(5) Fe常见晶体结构为体心立方堆积,原子半径为a nm,其晶胞中含有2个铁原子,体对角线是4anm,则晶胞边长是![]() 。I常见晶体结构为面心立方堆积,原子半径为b nm,则晶胞中含有4个铜原子,面对角线是4bnm,因此晶胞边长是
。I常见晶体结构为面心立方堆积,原子半径为b nm,则晶胞中含有4个铜原子,面对角线是4bnm,因此晶胞边长是![]() ,所以两种金属的密度比为
,所以两种金属的密度比为 =
=![]() 。
。
(6) 沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量,发现原绿色晶体的水溶液得到的白色沉淀质量为原紫色晶体的水溶液得到的沉淀质量的2/3。由于氯离子能与银离子结合形成氯化银白色沉淀,因此原紫色晶体中3个氯离子均不是配体,而绿色晶体配合物中有1个氯离子是配体,因此绿色晶体配合物的化学式为[TiCl(H2O)5]Cl2·H2O,由Cl-所形成的化学键类型是配位键和离子键。

 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案【题目】现有部分短周期元素的性质或原子结构如下表:
元素编号 | 元素性质或原子结构 |
T | 最外层电子数比内层电子总数少4 |
X | 最外层电子数是次外层电子数的2倍 |
Y | 与氢形成的气态化合物在标准状况下的密度为0.76g·L-1 |
Z | 元素最高正价与负价的绝对值之差是6 |
(1)元素X的一种同位素可测定文物年代,这种同位素的符号是 ,在周期表中的位置是 。
(2)元素Y与氢元素形成一种离子YH4+,写出该离子与Z离子形成化合物的电子式 。
(3)写出元素X、T形成的化合物XT2的电子式 。
(4)元素Z与元素T相比,非金属性较强的是 (用元素符号表示),下列表述中能证明这一事实的是 (填序号)。
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
d.与铁加热,Z生成三价铁,T生成二价铁
e.T原子与Z原子电子层数相同,Z原子半径小于T原子
(5)T的低价氧化物通入Z单质的水溶液中,发生反应的化学方程式为 。
(6)分别用电子式表示Z与镁元素、Y与氮元素形成化合物的过程: 。