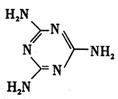
题目内容
下列说法正确的是
| A.原子最外层电子数为2的元素一定处于周期表的第IIA族 |
| B.构成单质的分子中一定含有共价键 |
| C.同主族元素形成的氧化物的晶体类型均相同 |
| D.金属与非金属元素形成的化合物可能是离子化合物 |
D
试题分析:某元素的原子最外层电子数为2,可能为原子核外只有一个电子层的稀有气体He,也可能是2个电子层以上的金属元素的原子,所以原子最外层电子数为2的元素不一定处于周期表的第IIA族,A错误,稀有气体是由原子构成的単原子分子,分子中无化学键,分子间存在分子间作用力,B错误,同主族元素形成的氧化物的晶体类型不一定相同,如CO2是分子晶体,SiO2是原子晶体,C错误,金属与非金属元素形成的化合物可能是离子化合物,也可能是共价化合物,如AlCl3就是一个由金属和非金属构成了共价化合物,Na2O、Na2O2都是离子化合物,D正确。

练习册系列答案
 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案
相关题目
 键 mol。
键 mol。

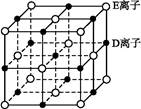



 、
、 两种可能,经证实
两种可能,经证实 不溶于
不溶于 等非极性溶剂。”据此可确定
等非极性溶剂。”据此可确定 中化学键类型为________。
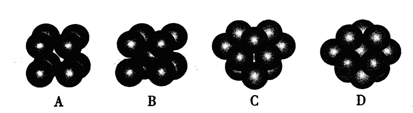
中化学键类型为________。 采用“…ABCABC…”型堆积方式,抽出一个晶胞,其正确的是________,
采用“…ABCABC…”型堆积方式,抽出一个晶胞,其正确的是________,
 则Pt原子的半径为_________pm(Pt的相对原子质量195.1)
则Pt原子的半径为_________pm(Pt的相对原子质量195.1) 和
和 ,它们都有很强的氧化性,
,它们都有很强的氧化性,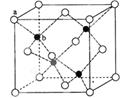
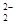 和O
和O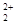 互为等电子体,所以可以推断O
互为等电子体,所以可以推断O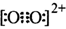
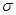 键。
键。